মানবদেহে প্রোটিনের ভূমিকা

শরীরের জন্য প্রোটিনের অত্যধিক গুরুত্ব তাদের কার্যকারিতার কারণে।
প্রোটিনের উপস্থাপিত মৌলিক কাজগুলি সাধারণ মানবজীবন নিশ্চিতকরণে এই শ্রেণীর পদার্থের গুরুত্ব চিত্রিত করে।
উনিশ শতকে বিজ্ঞানীরা বলেছিলেন:
- প্রোটিন সংস্থাগুলি অনন্য, জীবনের সারাংশ,
- জীবিত জিনিস এবং পরিবেশের মধ্যে একটি ধ্রুবক বিপাক প্রয়োজন।
এই বিধানগুলি বর্তমানে অপরিবর্তিত রয়েছে।
প্রোটিনের মূল রচনা
প্রোটিন নামক একটি সাধারণ প্রোটিনের বিশাল অণু ইউনিটগুলি রাসায়নিকভাবে সংযুক্ত ছোট ব্লকগুলি দ্বারা তৈরি হয় - অভিন্ন এবং বিভিন্ন টুকরা সহ অ্যামিনো অ্যাসিড। এ জাতীয় কাঠামোগত রচনাগুলিকে হেটেরোপলিমার বলা হয়। অ্যামিনো অ্যাসিডের শ্রেণির কেবলমাত্র 20 জন প্রতিনিধি প্রাকৃতিক প্রোটিনে সর্বদা পাওয়া যায়। প্রোটিনের মৌলিক গঠনটি কার্বন - সি, নাইট্রোজেন - এন, হাইড্রোজেন - এইচ, অক্সিজেন - ও সালফার - এসের বাধ্যতামূলক উপস্থিতি দ্বারা চিহ্নিত করা হয়। প্রোটিন নামক জটিল প্রোটিনগুলিতে অ্যামিনো অ্যাসিডের অবশিষ্টাংশ ছাড়াও অন্যান্য পদার্থ থাকে। তদনুসারে, ফসফরাস - পি, তামা - কিউ, আয়রন - ফে, আয়োডিন - আই, এবং সেলেনিয়াম - সে তাদের রচনায় থাকতে পারে।
প্রাকৃতিক প্রোটিনের অ্যামিনোকারবক্সিলিক অ্যাসিডগুলি রাসায়নিক কাঠামো এবং জৈবিক গুরুত্ব অনুসারে শ্রেণিবদ্ধ করা হয়। রাসায়নিক শ্রেণিবিন্যাস রসায়নবিদ, জৈবিক - সবার জন্য গুরুত্বপূর্ণ।
মানবদেহে সর্বদা দুটি রূপান্তর ঘটে:
- ভাঙ্গন, জারণ, খাদ্য পণ্য নিষ্পত্তি,
- নতুন প্রয়োজনীয় পদার্থগুলির জৈবিক সংশ্লেষণ।
প্রাকৃতিক প্রোটিনে সর্বদা পাওয়া 12 টি এমিনো অ্যাসিড মানব দেহের জৈবিক সংশ্লেষণ দ্বারা তৈরি করা যেতে পারে। এগুলিকে বিনিময়যোগ্য বলা হয়।
8 টি অ্যামাইনো অ্যাসিড কখনও কখনও সংশ্লেষিত হয় না মানুষের মধ্যে। এগুলি অনিবার্য, নিয়মিত খাবারের সাথে দেওয়া উচিত।
প্রয়োজনীয় অ্যামিনো-কার্বোঅক্সিলিক অ্যাসিডের উপস্থিতি অনুসারে, প্রোটিনগুলি দুটি শ্রেণিতে বিভক্ত হয়।
- সম্পূর্ণ প্রোটিনে মানব দেহের প্রয়োজনীয় সমস্ত অ্যামিনো অ্যাসিড থাকে। প্রয়োজনীয় অ্যামিনো অ্যাসিডের প্রয়োজনীয় সংখ্যায় রয়েছে কুটির পনির, দুগ্ধজাত পণ্য, হাঁস-মুরগির মাংস, সমুদ্র এবং মিঠা পানির মাছ, ডিমের প্রোটিন।
- ত্রুটিযুক্ত প্রোটিনগুলিতে, এক বা একাধিক গুরুত্বপূর্ণ অ্যাসিডের অভাব হতে পারে। এর মধ্যে রয়েছে উদ্ভিদ প্রোটিন।
ডায়েটরি প্রোটিনের গুণমান নির্ণয় করার জন্য, বিশ্ব চিকিত্সা সম্প্রদায় তাদেরকে "আদর্শ" প্রোটিনের সাথে তুলনা করে, যা প্রয়োজনীয় এবং প্রয়োজনীয় অপরিহার্য অ্যামিনো অ্যাসিডের অনুপাতে কঠোরভাবে যাচাই করেছে। প্রকৃতিতে, একটি "আদর্শ" প্রোটিনের অস্তিত্ব নেই। প্রাণী প্রোটিন হিসাবে তার কাছাকাছি। উদ্ভিদ প্রোটিন প্রায়শই এক বা একাধিক অ্যামিনো অ্যাসিডের আদর্শ ঘনত্বের পক্ষে পর্যাপ্ত নয়। যদি অনুপস্থিত পদার্থ যুক্ত হয় তবে প্রোটিন সম্পূর্ণ হয়ে যাবে।
উদ্ভিদ এবং প্রাণী উত্সের প্রোটিনের প্রধান উত্স
খাদ্য রসায়ন সম্পর্কিত একটি বিস্তৃত গবেষণায় জড়িত ঘরোয়া বৈজ্ঞানিক সম্প্রদায়টিতে, অধ্যাপক এ.পি. নেচেভ, তার সহকর্মী এবং শিক্ষার্থীদের একটি দল দাঁড়িয়ে আছে। দলটি রাশিয়ান বাজারে উপলব্ধ প্রধান খাদ্য পণ্যগুলিতে প্রোটিনের উপাদান নির্ধারণ করে।
- গুরুত্বপূর্ণ! শনাক্তকৃত পরিসংখ্যানগুলি পণ্যটির 100 গ্রাম প্রোটিন উপাদান সম্পর্কে অখাদ্য অংশ থেকে মুক্তি সম্পর্কে অবহিত করে।
- সয়াবিন, কুমড়োর বীজ এবং চিনাবাদামে (34.9 - 26.3 গ্রাম) সর্বাধিক পরিমাণে প্রোটিন পাওয়া যায়।
- মটর, শিম, পেস্তা এবং সূর্যমুখী বীজের মধ্যে 20 থেকে 30 গ্রাম মানের মান পাওয়া যায়।
- বাদাম, কাজু, হ্যাজনেল্ট 15 থেকে 20 জিআর পর্যন্ত সংখ্যার দ্বারা চিহ্নিত করা হয়।
- আখরোট, পাস্তা, বেশিরভাগ সিরিয়াল (চাল, ভুট্টা গ্রিট বাদে) প্রতি 100 গ্রাম পণ্যতে 10 থেকে 15 গ্রাম প্রোটিন থাকে।
- ভাত, কর্ন গ্রিটস, রুটি, রসুন, শুকনো এপ্রিকটস 5 থেকে 10 জিআর মধ্যে হয়।
- 100 গ্রাম বাঁধাকপি, মাশরুম, আলু, prunes, কিছু বীট জাত, প্রোটিন উপাদান 2 থেকে 5 গ্রাম পর্যন্ত হয়।
- কিসমিস, মূলা, গাজর, মিষ্টি মরিচগুলিতে খুব কম প্রোটিন থাকে, তাদের সূচকগুলি 2 গ্রামের বেশি হয় না।
আপনি যদি এখানে কোনও উদ্ভিদ সামগ্রী খুঁজে পেতে অক্ষম হন তবে এতে প্রোটিনের ঘনত্ব খুব কম বা এটি মোটেই নেই not উদাহরণস্বরূপ, ফলের রসগুলিতে খুব কম প্রোটিন থাকে, প্রাকৃতিক উদ্ভিজ্জ তেলগুলিতে - মোটেই না।
- সর্বাধিক প্রোটিনের ঘনত্ব ফিশ রো, হার্ড এবং প্রসেসড চিজ এবং খরগোশের মাংসে পাওয়া গেছে (21.1 থেকে 28.9 গ্রাম পর্যন্ত)।
- প্রচুর পরিমাণে পণ্যগুলিতে 15 থেকে 10 গ্রাম প্রোটিন থাকে। এটি একটি পাখি, সমুদ্রের মাছ (ক্যাপেলিন ব্যতীত), গরুর মাংস, চিংড়ি, স্কুইড, কুটির পনির, ফেটা পনির, মিঠা পানির মাছ।
- ক্যাপেলিন, মুরগির ডিম, শুয়োরের মাংসে প্রতি 100 গ্রাম পণ্যগুলিতে 12.7 থেকে 15 গ্রাম প্রোটিন থাকে।
- দই, দই পনির 5 - 7.1 জিআর সংখ্যা দ্বারা চিহ্নিত করা হয়।
- দুধ, কেফির, ফেরেন্টেড বেকড মিল্ক, টক ক্রিম, ক্রিম 2.8 থেকে 3 গ্রাম প্রোটিন ধারণ করে।
মাল্টি-স্টেজ টেকনোলজিকাল প্রসেসিং (স্টিউ, সসেজস, হ্যাম, সসেজস) পণ্যগুলির মধ্যে উদ্ভিদ এবং প্রাণী উত্সের প্রোটিনের প্রধান উত্স সম্পর্কিত তথ্য আগ্রহী নয়। নিয়মিত স্বাস্থ্যকর খাওয়ার জন্য তাদের সুপারিশ করা হয় না। এই জাতীয় পণ্যগুলির স্বল্পমেয়াদী ব্যবহার তাৎপর্যপূর্ণ নয়।
পুষ্টিতে প্রোটিনের ভূমিকা
দেহে বিপাকীয় প্রক্রিয়াগুলির ফলস্বরূপ, পুরানোগুলির পরিবর্তে ক্রমাগত নতুন প্রোটিন অণু গঠিত হয়। বিভিন্ন অঙ্গের সংশ্লেষণের হার এক নয়। হরমোন প্রোটিন, উদাহরণস্বরূপ, ইনসুলিন খুব দ্রুত, ঘন্টা, মিনিটের মধ্যে পুনরুদ্ধার করা হয় (পুনরায় সংশ্লেষিত)। লিভারের প্রোটিনগুলি, অন্ত্রের শ্লেষ্মা ঝিল্লি 10 দিনের মধ্যে পুনরায় জন্মে। মস্তিষ্কের প্রোটিন অণু, পেশী, সংযোজক টিস্যুগুলি দীর্ঘতম পুনরুদ্ধার করা হয়, পুনরুদ্ধার সংশ্লেষণ (পুনরায় সংশ্লেষ) ছয় মাস পর্যন্ত স্থায়ী হতে পারে।
ব্যবহার এবং সংশ্লেষণ প্রক্রিয়া একটি নাইট্রোজেন ভারসাম্য দ্বারা চিহ্নিত করা হয়।
- পূর্ণ স্বাস্থ্য সহ একটি গঠিত ব্যক্তির মধ্যে নাইট্রোজেনের ভারসাম্য শূন্য। এই ক্ষেত্রে, পুষ্টির সময় প্রোটিনের সাথে সরবরাহ করা মোট নাইট্রোজেনের ক্ষয় ক্ষয়ের পণ্যগুলির সাথে মিশ্রিত ভরগুলির সমান।
- তরুণ জীব দ্রুত বিকাশ করছে। নাইট্রোজেনের ভারসাম্য ইতিবাচক। প্রচুর প্রোটিন রয়েছে, কম পরিমাণে মলত্যাগ হয়।
- বার্ধক্যজনিত, অসুস্থ ব্যক্তিদের মধ্যে নাইট্রোজেনের ভারসাম্য নেতিবাচক থাকে। বিপাকীয় পণ্যগুলির সাথে প্রকাশিত নাইট্রোজেনের পরিমাণ খাদ্য গ্রহণের চেয়ে প্রাপ্তির চেয়ে বেশি।
পুষ্টিতে প্রোটিনের ভূমিকা হ'ল কোনও ব্যক্তিকে শরীরের জৈব রাসায়নিক প্রক্রিয়াগুলিতে অংশগ্রহণের জন্য উপযুক্ত পরিমাণে অ্যামিনো অ্যাসিড উপাদান সরবরাহ করা provide
একটি সাধারণ বিপাক নিশ্চিত করতে, একজন ব্যক্তিকে প্রতিদিন কত প্রোটিন গ্রহণ করা প্রয়োজন তা জানা গুরুত্বপূর্ণ।
গার্হস্থ্য এবং আমেরিকান ফিজিওলজিস্টরা মানব ওজনের প্রতি কেজি 0.8 - 1 গ্রাম প্রোটিন খাওয়ার পরামর্শ দেন। সংখ্যাগুলি বেশ গড় হয়। পরিমাণ কোনও ব্যক্তির বয়স, কাজের প্রকৃতি এবং জীবনধারার উপর নির্ভর করে। গড়ে, তারা প্রতিদিন 60 গ্রাম থেকে 100 গ্রাম প্রোটিন গ্রহণের পরামর্শ দেয়। শারীরিক কাজে নিযুক্ত পুরুষদের জন্য, আদর্শটি প্রতিদিন 120 গ্রামে বাড়ানো যেতে পারে। যারা শল্য চিকিত্সা, সংক্রামক রোগের মধ্য দিয়ে চলেছেন তাদের ক্ষেত্রেও আদর্শটি প্রতিদিন বেড়েছে 140 গ্রাম। ডায়াবেটিস রোগীদের উচ্চমাত্রায় প্রোটিন পণ্যযুক্ত ডায়েটগুলির পরামর্শ দেওয়া হয়, যা প্রতিদিন 140 গ্রামে পৌঁছতে পারে। বিপাকীয় রোগগুলি, গাউট হওয়ার প্রবণতাযুক্ত ব্যক্তিদের মধ্যে উল্লেখযোগ্যভাবে কম প্রোটিন গ্রহণ করা উচিত। তাদের জন্য আদর্শ প্রতিদিন 20 - 40 গ্রাম।
সক্রিয় ক্রীড়াগুলির সাথে জড়িত ব্যক্তিদের জন্য যারা পেশী ভর বৃদ্ধি করে, আদর্শটি উল্লেখযোগ্যভাবে বৃদ্ধি পায়, অ্যাথলিটের ওজনে প্রতি কেজি 1.6-1.8 গ্রামে পৌঁছতে পারে।
- গুরুত্বপূর্ণ! প্রশিক্ষকের পক্ষে এই প্রশ্নের উত্তরটি পরিষ্কার করার পরামর্শ দেওয়া হয় - অনুশীলনের সময় প্রতিদিন কত প্রোটিন খাওয়া উচিত। পেশাদারদের সমস্ত ধরণের প্রশিক্ষণের জন্য শক্তি ব্যয়, ক্রীড়াবিদদের শরীরের স্বাভাবিক ক্রিয়াকলাপ বজায় রাখার উপায়গুলি সম্পর্কে তথ্য রয়েছে have
সমস্ত শারীরবৃত্তীয় ক্রিয়াকলাপ বাস্তবায়নের জন্য, এটি কেবল প্রোটিনে প্রয়োজনীয় অ্যামিনো অ্যাসিডের উপস্থিতিই নয়, তাদের সংশ্লেষের দক্ষতাও গুরুত্বপূর্ণ। প্রোটিন অণুর বিভিন্ন স্তরের সংগঠন, দ্রবণীয়তা, হজম এনজাইমগুলির অ্যাক্সেসযোগ্যতার ডিগ্রি রয়েছে। দুধ প্রোটিনের 96%, ডিমগুলি কার্যকরভাবে ভেঙে যায়। মাংসে, মাছগুলিতে, 93-95% প্রোটিন নিরাপদে হজম হয়। ব্যতিক্রম ত্বক এবং চুলের প্রোটিন। উদ্ভিজ্জ প্রোটিনযুক্ত পণ্যগুলি 60-80% দ্বারা হজম হয়। শাকসবজিতে, 80% প্রোটিন শোষিত হয়, আলুতে - 70%, রুটিতে - 62-86%।
প্রাণীর উত্স থেকে প্রোটিনের প্রস্তাবিত অংশটি প্রোটিন ভরগুলির মোট পরিমাণের 55% হওয়া উচিত।
- দেহে প্রোটিনের ঘাটতি উল্লেখযোগ্য বিপাকীয় পরিবর্তনের দিকে পরিচালিত করে। এই ধরনের প্যাথলজগুলিকে ডাইস্ট্রোফি, কোওয়াশিওরকর বলা হয়। প্রথমবারের জন্য, আফ্রিকার বন্য উপজাতির বাসিন্দাদের মধ্যে একটি লঙ্ঘন প্রকাশিত হয়েছিল, এটি নেতিবাচক নাইট্রোজেন ভারসাম্য, অন্ত্রের অন্ত্রের ক্রিয়া, পেশী সংশ্লেষ এবং স্তব্ধ বৃদ্ধি দ্বারা চিহ্নিত হয়েছিল। আংশিক প্রোটিনের ঘাটতি একই রকম লক্ষণগুলির সাথে দেখা দিতে পারে যা কিছু সময়ের জন্য হালকা হতে পারে। বিশেষত বিপজ্জনক হ'ল সন্তানের শরীরে প্রোটিনের অভাব। এই জাতীয় ডায়েটরিটিগুলি ক্রমবর্ধমান ব্যক্তির শারীরিক এবং বৌদ্ধিক হীনমন্যতা প্ররোচিত করতে পারে।
- দেহে অতিরিক্ত প্রোটিন মলমূত্র সিস্টেমকে ওভারলোড করে। কিডনিতে বোঝা বাড়ে। কিডনি টিস্যুতে বিদ্যমান প্যাথলজগুলি সহ, প্রক্রিয়াটি আরও বাড়ানো যেতে পারে। এটি খুব খারাপ যদি শরীরে অতিরিক্ত প্রোটিনের সাথে অন্যান্য মূল্যবান খাদ্য উপাদানগুলির অভাব হয়। প্রাচীনকালে, এশিয়ার দেশগুলিতে ফাঁসি কার্যকর করার একটি পদ্ধতি ছিল, যেখানে আসামীকে কেবল মাংস খাওয়ানো হত। ফলস্বরূপ, অপরাধী এই বিষক্রিয়া অনুসরণ করে অন্ত্রের পচা পণ্য তৈরি থেকে মারা যায়।
শরীরকে প্রোটিন সরবরাহ করার জন্য একটি যুক্তিসঙ্গত পন্থা সমস্ত জীবন ব্যবস্থার কার্যকর পরিচালনার গ্যারান্টি দেয়।
অধ্যয়নের ইতিহাস

প্রোটিনটি প্রথমবার (আঠালো আকারে) ইতালির জ্যাকোপা বার্তোলোমিও বেকারি গমের আটা থেকে পেয়েছিলেন। আঠারো শতকে ফরাসী রসায়নবিদ এন্টোইন ডি ফোরক্রোইক্স এবং অন্যান্য বিজ্ঞানীরা যারা তাপ বা অ্যাসিডের প্রভাবে প্রোটিনের জমাট বাঁধার (স্বচ্ছলতা) হিসাবে চিহ্নিত করেছিলেন তার ফলস্বরূপ প্রোটিনগুলি পৃথক শ্রেণীর জৈবিক অণুগুলিতে বিচ্ছিন্ন হয়ে পড়েছিল। সেই সময়, অ্যালবামিন ("ডিমের সাদা"), ফাইব্রিন (রক্ত থেকে প্রোটিন) এবং গমের দানা থেকে আঠালো জাতীয় প্রোটিনগুলি তদন্ত করা হয়েছিল।
উনিশ শতকের গোড়ার দিকে প্রোটিনের প্রাথমিক রচনা সম্পর্কে ইতিমধ্যে কিছু তথ্য প্রাপ্ত হয়েছিল; জানা গিয়েছিল যে প্রোটিনের হাইড্রোলাইসিসের সময় অ্যামিনো অ্যাসিড গঠিত হয়। এর মধ্যে কয়েকটি অ্যামিনো অ্যাসিড (উদাঃ গ্লাইসিন এবং লিউসিন) এরই মধ্যে চিহ্নিত করা হয়েছে। প্রোটিনের রাসায়নিক সংমিশ্রণের বিশ্লেষণের ভিত্তিতে ডাচ রসায়নবিদ গেরিট মুল্ডার অনুমান করেছিলেন যে প্রায় সমস্ত প্রোটিনের সমান অভিজ্ঞতামূলক সূত্র রয়েছে। 1836 সালে মুলদার প্রোটিনের রাসায়নিক কাঠামোর প্রথম মডেলটি প্রস্তাব করেছিলেন। র্যাডিকালগুলির তত্ত্বের ভিত্তিতে, তিনি বেশ কয়েকটি পরিশোধন শেষে এই সিদ্ধান্তে এসেছিলেন যে কোনও প্রোটিনের ন্যূনতম কাঠামোয় ইউনিটের নিম্নলিখিত রচনা রয়েছে: সি40এইচ62এন10হে12। তিনি এই ইউনিটটিকে "প্রোটিন" (প্রি) বলেছিলেন (গ্রীক থেকে। প্রোটোস - প্রথম, প্রাথমিক) এবং তত্ত্ব - "প্রোটিন তত্ত্ব"। "প্রোটিন" শব্দটি নিজেই সুইডিশ রসায়নবিদ জ্যাকব বারজেলিয়াস প্রস্তাব করেছিলেন। মুল্ডারের মতে, প্রতিটি প্রোটিনে বেশ কয়েকটি প্রোটিন ইউনিট, সালফার এবং ফসফরাস থাকে। উদাহরণস্বরূপ, তিনি 10 পিআরএসপি হিসাবে ফাইব্রিন সূত্র লেখার পরামর্শ দিয়েছেন। মুলার প্রোটিনগুলির ধ্বংসের পণ্যগুলিও অ্যামিনো অ্যাসিড এবং তার মধ্যে একটির জন্য (লিউসিন) একটি ত্রুটিযুক্ত ক্ষুদ্র ভগ্নাংশ নিয়ে অধ্যয়ন করেছিলেন, তিনি আণবিক ওজন নির্ধারণ করেছিলেন - 131 ডাল্টন। প্রোটিনগুলিতে নতুন ডেটা জমা হওয়ার সাথে সাথে প্রোটিনের তত্ত্বের সমালোচনা করা শুরু হয়েছিল, তবে এটি সত্ত্বেও, 1850 এর দশক অবধি এটি এখনও সর্বজনীন স্বীকৃত হিসাবে বিবেচিত হত।
উনিশ শতকের শেষের দিকে, প্রোটিন তৈরির বেশিরভাগ অ্যামিনো অ্যাসিডগুলি তদন্ত করা হয়েছিল। 1880 এর দশকের শেষদিকে। রাশিয়ান বিজ্ঞানী এ।ড্যানিলেভস্কি প্রোটিনের অণুতে পেপটাইড গ্রুপ (সিও - এনএইচ) এর অস্তিত্ব উল্লেখ করেছিলেন। 1894 সালে, জার্মান ফিজিওলজিস্ট অ্যালব্রেক্ট কোসেল একটি তত্ত্ব পেশ করেছিলেন যা অনুসারে অ্যামিনো অ্যাসিডগুলি প্রোটিনের মূল কাঠামোগত উপাদান elements বিংশ শতাব্দীর শুরুতে, জার্মান রসায়নবিদ এমিল ফিশার পরীক্ষামূলকভাবে প্রমাণ করেছিলেন যে প্রোটিনগুলি এমিনো অ্যাসিডের অবশিষ্টাংশগুলি পেপটাইড বন্ড দ্বারা সংযুক্ত থাকে। তিনি প্রোটিনের অ্যামিনো অ্যাসিড অনুক্রমের প্রথম বিশ্লেষণও করেছিলেন এবং প্রোটোলাইসিসের ঘটনাটি ব্যাখ্যা করেছিলেন।
যাইহোক, আমেরিকান রসায়নবিদ জেমস সুমনার (পরে রসায়নের নোবেল পুরস্কার) দেখিয়েছিলেন যে ইউরিজ এনজাইম একটি প্রোটিন, তখন জীবদেহে প্রোটিনগুলির কেন্দ্রীয় ভূমিকা স্বীকৃত ছিল না।
খাঁটি প্রোটিনগুলি বিচ্ছিন্ন করার অসুবিধা অধ্যয়ন করতে অসুবিধে করেছে। অতএব, প্রথম অধ্যয়নগুলি সেই পলিপপটিডগুলি ব্যবহার করে পরিচালিত হয়েছিল যা সহজেই প্রচুর পরিমাণে পরিশোধিত হতে পারে, যা রক্তের প্রোটিন, মুরগির ডিম, বিভিন্ন টক্সিন, পাশাপাশি গবাদি পশু জবাইয়ের পরে হজম / বিপাকীয় এনজাইমগুলি গোপন করা হয়। 1950 এর দশকের শেষদিকে, সংস্থাটি আর্মার হট ডগ কো এক কেজি বোভাইন অগ্ন্যাশয় রিবোনুক্লেজ এ সাফ করতে সক্ষম হয়েছিলেন, যা অনেক গবেষণার জন্য পরীক্ষামূলক বস্তুতে পরিণত হয়েছে।
প্রোটিনগুলির গৌণ গঠনটি অ্যামিনো অ্যাসিডের অবশিষ্টাংশের মধ্যে হাইড্রোজেন বন্ধন গঠনের ফলাফল বলে ধারণাটি ১৯৩৩ সালে উইলিয়াম অ্যাস্টবারি রেখেছিলেন, তবে লিনাস পলিং প্রথম বিজ্ঞানী হিসাবে বিবেচিত হন যিনি প্রোটিনের দ্বিতীয় স্তরের সাফল্যের সাথে ভবিষ্যদ্বাণী করতে সক্ষম হয়েছিলেন। পরে, কাই লিনারস্ট্রম-ল্যাংয়ের কাজের উপর ভিত্তি করে ওয়াল্টার কাউসমান প্রোটিনের তৃতীয় স্তর গঠনের আইন এবং এই প্রক্রিয়াতে হাইড্রোফোবিক মিথস্ক্রিয়ের ভূমিকা বোঝার ক্ষেত্রে গুরুত্বপূর্ণ অবদান রেখেছিলেন। ১৯৪০ এর দশকের শেষের দিকে এবং ১৯৫০ এর দশকের গোড়ার দিকে ফ্রেডরিক সেন্টার প্রোটিন সিকোয়েন্সিংয়ের একটি পদ্ধতি তৈরি করেছিলেন, যার মাধ্যমে তিনি ১৯৫৫ সালে দুটি ইনসুলিন চেইনের অ্যামিনো অ্যাসিডের অনুক্রম নির্ধারণ করেছিলেন, যে প্রোটিনগুলি অ্যামিনো অ্যাসিডের লিনিয়ার পলিমার, এবং ব্রাঞ্চ নয় (কিছু শর্করা হিসাবে) ) চেইন, কলয়েড বা সাইক্লোল। প্রথম প্রোটিন, অ্যামিনো অ্যাসিড ক্রম যা সোভিয়েত / রাশিয়ান বিজ্ঞানীদের দ্বারা প্রতিষ্ঠিত হয়েছিল, ১৯ asp২ সালে এম্পিনেট অ্যামিনোট্রান্সফেরেজ।
এক্স-রে ডিফারকশন (এক্স-রে সংক্ষেপণ বিশ্লেষণ) দ্বারা প্রাপ্ত প্রোটিনগুলির প্রথম স্থানিক কাঠামো 1950 এর দশকের শেষের দিকে এবং 1960 এর দশকের প্রথম দিকে পরিচিত হয়ে ওঠে এবং 1980 এর দশকে পারমাণবিক চৌম্বকীয় অনুরণন ব্যবহার করে আবিষ্কার করা কাঠামোগুলি আবিষ্কার হয়। ২০১২ সালে, প্রোটিন ডেটা ব্যাংকে প্রায় 87,000 প্রোটিন কাঠামো রয়েছে।
একবিংশ শতাব্দীতে, প্রোটিন গবেষণা একটি গুণগতভাবে নতুন স্তরে চলে এসেছিল, যখন কেবল পৃথক শোধিত প্রোটিনগুলিই অধ্যয়ন করা হয় না, তবে পৃথক কোষ, টিস্যু বা সমগ্র জীবের একটি বৃহত সংখ্যক প্রোটিনের সংখ্যা এবং উত্তর-পরবর্তী পরিবর্তনগুলির একসাথে পরিবর্তনও ঘটে। জৈব রসায়নের এই অঞ্চলটিকে বলা হয় প্রোটোমিক্স। বায়োইনফরমেটিক্স পদ্ধতি ব্যবহার করে, কেবল এক্স-রে বিচ্ছুরণ বিশ্লেষণের ডেটা প্রক্রিয়া করা সম্ভব হয়নি, তবে এর অ্যামিনো অ্যাসিডের ক্রমের ভিত্তিতে প্রোটিনের কাঠামোর পূর্বাভাস দেওয়াও সম্ভব হয়েছে। বর্তমানে, বৃহত প্রোটিন কমপ্লেক্সগুলির ক্রিয়োলেক্ট্রনিক মাইক্রোস্কোপি এবং কম্পিউটার প্রোগ্রামগুলি ব্যবহার করে প্রোটিন ডোমেনগুলির স্থানিক কাঠামোর পূর্বাভাস পারমাণবিক নির্ভুলতার কাছে পৌঁছেছে।

প্রোটিনের আকারটি অ্যামিনো অ্যাসিডের অবশিষ্টাংশের ক্ষেত্রে বা ডাল্টনগুলিতে (আণবিক ওজন) পরিমাপ করা যেতে পারে, তবে অণুর তুলনামূলকভাবে বড় আকারের কারণে, প্রোটিন ভর উদ্ভূত ইউনিটগুলিতে প্রকাশিত হয় - কিলোডাল্টনস (কেডিএ)। খামির প্রোটিনগুলি গড়ে 466 এমিনো অ্যাসিডের অবশিষ্টাংশ নিয়ে গঠিত এবং এর আণবিক ওজন 53 কেডিএ হয়। টাইটিন - বর্তমানে পরিচিত বৃহত্তম প্রোটিন হ'ল পেশী সরমেরেসের একটি উপাদান, এর বিভিন্ন রূপের (আইসোফর্মস) এর আণবিক ওজন 3000 থেকে 3700 কেডিএর মধ্যে থাকে। কোনও ব্যক্তির একমাত্র পেশী (ল্যাট। সোলেয়াস) এর টাইটিন 38,138 অ্যামিনো অ্যাসিড নিয়ে গঠিত।
Amphoteric
প্রোটিনগুলির এমফোটেরিসিটির সম্পত্তি রয়েছে, যা শর্তের উপর নির্ভর করে তারা অ্যাসিডিক এবং মৌলিক উভয় বৈশিষ্ট্যই প্রদর্শন করে। প্রোটিনগুলিতে জলীয় দ্রবণে আয়নিকরণে সক্ষম বিভিন্ন ধরণের রাসায়নিক গ্রুপ রয়েছে: অ্যাসিড অ্যামিনো অ্যাসিডের পার্শ্ব চেইনের কার্বোক্সেলিক অ্যাসিডের অবশিষ্টাংশ (অ্যাস্পারটিক এবং গ্লুটামিক অ্যাসিড) এবং নাইট্রোজেনযুক্ত বেসিক অ্যামিনো অ্যাসিডের সাইডের চেইনগুলির গ্রুপগুলি (মূলত লিসিনের অ্যামিনো গ্রুপ এবং এমিডিনহাইড সিএনহিউএনইউ)2) আর্গিনাইন, কিছুটা কম পরিমাণে - ইমিডাজল হিস্টিডিন অবশিষ্টাংশ)। প্রতিটি প্রোটিন একটি আইসোইলেকট্রিক পয়েন্ট (পিআই) দ্বারা চিহ্নিত করা হয় - মাঝারি অম্লতা (পিএইচ), যেখানে এই প্রোটিনের অণুগুলির মোট বৈদ্যুতিক চার্জ শূন্য হয় এবং তদনুসারে, তারা বৈদ্যুতিক ক্ষেত্রে সরানো হয় না (উদাহরণস্বরূপ, ইলেক্ট্রোফোরসিস দ্বারা)। আইসোইলেকট্রিক পয়েন্টে, প্রোটিনের হাইড্রেশন এবং দ্রবণীয়তা ন্যূনতম are পিআই মান একটি প্রোটিনের অম্লীয় ও বেসিক অ্যামিনো অ্যাসিডের অবশিষ্টাংশের অনুপাতের উপর নির্ভর করে: অনেক অ্যাসিডিক অ্যামিনো অ্যাসিডের অবশিষ্টাংশ যুক্ত প্রোটিনের জন্য, আইসোইলেকট্রিক পয়েন্টগুলি অম্লীয় অঞ্চলে থাকে (যেমন প্রোটিনকে অ্যাসিড বলা হয়), এবং আরও বেসিক অবশিষ্টাংশ যুক্ত প্রোটিনগুলিতে তারা ক্ষারীয় অঞ্চলে থাকে (বেসিক প্রোটিন) )। এই প্রোটিনের পিআই মান এছাড়াও আয়নিক শক্তি এবং এটিতে অবস্থিত বাফার সমাধানের ধরণের উপর নির্ভর করে পরিবর্তিত হতে পারে, যেহেতু নিরপেক্ষ লবণগুলি প্রোটিনের রাসায়নিক গ্রুপগুলির আয়নীকরণের ডিগ্রিকে প্রভাবিত করে। একটি প্রোটিনের পিআই নির্ধারণ করা যেতে পারে, উদাহরণস্বরূপ, একটি টাইটেশন বক্র থেকে বা আইসোইলেকট্রিক ফোকাস করে।
সাধারণভাবে, একটি প্রোটিনের পিআই এটি সম্পাদন করে এমন ফাংশনটির উপর নির্ভর করে: ভার্টাইবারেট টিস্যুতে বেশিরভাগ প্রোটিনের আইসোইলেকট্রিক পয়েন্ট 5.5 থেকে 7.0 অবধি থাকে তবে কিছু ক্ষেত্রে মানগুলি চূড়ান্ত অঞ্চলে থাকে: উদাহরণস্বরূপ, পেপসিনের জন্য, দৃ strongly় অ্যাসিডযুক্ত গ্যাস্ট্রিকের একটি প্রোটোলিটিক এনজাইম রস পিআই
1, এবং সালমিনগুলির জন্য - সালমন মিল্কের প্রোটামাইন প্রোটিন, এর বৈশিষ্ট্য একটি উচ্চ আর্জিনিন সামগ্রী - পিআই
12. ফসফেট গ্রুপগুলির সাথে বৈদ্যুতিন সংযোগের কারণে নিউক্লিক অ্যাসিডের সাথে আবদ্ধ হওয়া প্রোটিনগুলি প্রায়শই প্রধান প্রোটিন হয়। এই জাতীয় প্রোটিনগুলির একটি উদাহরণ হিস্টোন এবং প্রোটামাইন।
প্রোটিন কি?
প্রোটিনগুলি উচ্চ আণবিক ওজন জটিল জৈব যৌগগুলি যা অ্যামিনো অ্যাসিডের অবশিষ্টাংশ সমন্বয়ে একটি বিশেষ উপায়ে মিশ্রিত হয়। প্রতিটি প্রোটিনের নিজস্ব স্বতন্ত্র অ্যামিনো অ্যাসিড ক্রম রয়েছে, এটি স্থানের মধ্যে রয়েছে। এটি বোঝা গুরুত্বপূর্ণ যে দেহে প্রবেশকারী প্রোটিনগুলি অপরিবর্তিত আকারে তাদের দ্বারা শোষিত হয় না, তারা অ্যামিনো অ্যাসিডে ভেঙে যায় এবং তাদের সহায়তায় শরীর তার প্রোটিনগুলি সংশ্লেষ করে।
22 অ্যামিনো অ্যাসিড প্রোটিন গঠনে অংশ নেয়, তাদের 13 টি একে অপরকে রূপান্তরিত করা যেতে পারে, 9 - ফেনিল্লানাইন, ট্রাইপটোফান, লাইসিন, হিস্টিডিন, থ্রোনাইন, লিউসিন, ভালাইন, আইসোলিউসিন, মেথিওনিন - অপরিবর্তনীয়। শরীরে অপরিবর্তনীয় অ্যাসিডের অভাব অগ্রহণযোগ্য, এটি শরীরের ব্যাঘাত ঘটায়।
এটি কেবল প্রোটিন শরীরে প্রবেশ করে তা নয়, তবে এটিতে কী অ্যামিনো অ্যাসিড রয়েছে তাও গুরুত্বপূর্ণ!

প্রোটিন কী?
প্রোটিন (প্রোটিন / পলিপেসিড) - জৈব পদার্থ, প্রাকৃতিক পলিমারগুলিতে বিশটি সম্পর্কিত অ্যামিনো অ্যাসিড থাকে। সংমিশ্রণ বিভিন্ন ধরণের সরবরাহ করে। দেহ বারোটি বিনিময়যোগ্য অ্যামিনো অ্যাসিডের সংশ্লেষণের সাথে কপি করে।
প্রোটিনে পাওয়া বিশটি অত্যাবশ্যক অ্যামিনো অ্যাসিডগুলির মধ্যে আটটি তাদের নিজের দ্বারা দেহ দ্বারা সংশ্লেষিত করা যায় না, তারা খাদ্য দিয়ে প্রাপ্ত হয়। এগুলি ভ্যালাইন, লিউসিন, আইসোলিউসিন, মেথিওনাইন, ট্রিপটোফেন, লাইসিন, থ্রোনাইন, ফেনিল্যানালাইন যা জীবনের জন্য গুরুত্বপূর্ণ।
প্রোটিন কি হয়
প্রাণী এবং উদ্ভিজ্জ (উত্স অনুসারে) মধ্যে পার্থক্য করুন। দুই ধরণের খরচ প্রয়োজন।
পশু:
ডিমের সাদা সহজেই এবং প্রায় সম্পূর্ণরূপে শরীর দ্বারা শোষিত হয় (90-92%)। গাঁজন দুধের প্রোটিনগুলি কিছুটা খারাপ (90% পর্যন্ত)। টাটকা পুরো দুধের প্রোটিনগুলি আরও কম শোষিত হয় (80% পর্যন্ত)।
জরুরী অ্যামিনো অ্যাসিডের সর্বোত্তম সংমিশ্রণে গরুর মাংস এবং মাছের মান।
গাছগাছালি:
সয়া, ক্যানোলা এবং সুতোর বীজের জন্য শরীরের জন্য ভাল অ্যামিনো অ্যাসিড অনুপাত রয়েছে। ফসলে, এই অনুপাতটি দুর্বল।
আদর্শ অ্যামিনো অ্যাসিড অনুপাত সহ কোনও পণ্য নেই। সঠিক পুষ্টিতে প্রাণী এবং উদ্ভিজ্জ প্রোটিনের সংমিশ্রণ জড়িত।
"নিয়ম অনুসারে" পুষ্টির ভিত্তি হ'ল প্রাণী প্রোটিন। এটি প্রয়োজনীয় অ্যামিনো অ্যাসিড সমৃদ্ধ, এবং উদ্ভিজ্জ প্রোটিনের ভাল শোষণ সরবরাহ করে।
দেহে প্রোটিন কাজ করে
টিস্যুর কোষে থাকায় এটি অনেকগুলি কার্য সম্পাদন করে:
- প্রতিরক্ষামূলক। প্রতিরোধ ব্যবস্থাটির কার্যকারিতা হ'ল বিদেশী পদার্থের নিরপেক্ষতা। অ্যান্টিবডি উত্পাদন ঘটে।
- পরিবহন। বিভিন্ন পদার্থের সরবরাহ, উদাহরণস্বরূপ, হিমোগ্লোবিন (অক্সিজেন সরবরাহ)।
- রেগুলেটরি। হরমোনীয় পটভূমি বজায় রাখা।
- মোটর। সমস্ত ধরণের আন্দোলন অ্যাক্টিন এবং মায়োসিন সরবরাহ করে।
- প্লাস্টিক। সংযোগকারী টিস্যুর অবস্থা কোলাজেন সামগ্রী দ্বারা নিয়ন্ত্রিত হয়।
- অনুঘটকের। এটি অনুঘটক এবং সমস্ত বায়োকেমিক্যাল প্রতিক্রিয়ার উত্তরণকে ত্বরান্বিত করে।
- জিনের তথ্য সংরক্ষণ এবং সংক্রমণ (ডিএনএ এবং আরএনএ অণু)।
- শক্তি। শক্তি সঙ্গে পুরো শরীরের সরবরাহ।
অন্যরা শ্বাস প্রশ্বাস সরবরাহ করে, খাদ্য হজমের জন্য দায়ী, বিপাক নিয়ন্ত্রণ করে। ফটোসেন্সিভ রোডোপসিন প্রোটিন ভিজ্যুয়াল ফাংশনের জন্য দায়ী।
রক্তনালীতে ইলাস্টিন থাকে, ধন্যবাদ এটি সম্পূর্ণরূপে কাজ করে। ফাইব্রিনোজেন প্রোটিন রক্ত জমাট সরবরাহ করে।
শরীরে প্রোটিনের অভাবের লক্ষণ
প্রোটিনের ঘাটতি হ'ল আধুনিক ব্যক্তির অপুষ্টি এবং হাইপারেটিভ লাইফস্টাইল সহ মোটামুটি সাধারণ ঘটনা। একটি হালকা ফর্ম এটি নিয়মিত ক্লান্তি এবং দুর্বল কর্মক্ষমতা প্রকাশ করা হয়। অপর্যাপ্ত পরিমাণে বাড়ার সাথে সাথে শরীর লক্ষণগুলির মাধ্যমে সংকেত দেয়:
- সাধারণ দুর্বলতা এবং মাথা ঘোরা। হ্রাস মেজাজ এবং ক্রিয়াকলাপ, বিশেষ শারীরিক পরিশ্রম ছাড়াই পেশী ক্লান্তির উপস্থিতি, আন্দোলনের প্রতিবন্ধী সমন্বয়, মনোযোগ এবং স্মৃতিশক্তি দুর্বল হওয়া।
- মাথা ব্যথা এবং ঘুম খারাপ। ফলে অনিদ্রা এবং উদ্বেগ সেরোটোনিনের ঘাটতি নির্দেশ করে।
- ঘন ঘন মেজাজ দোল, গ্রান্টস। এনজাইম এবং হরমোনের অভাব স্নায়ুতন্ত্রের ক্লান্তি উত্সাহিত করে: কোনও কারণে বিরক্তিকর, অযৌক্তিক আগ্রাসন, সংবেদনশীল সংযম।
- ফ্যাকাশে ত্বক, ফুসকুড়ি। আয়রনযুক্ত প্রোটিনের অভাবের সাথে রক্তাল্পতা বিকাশ হয়, এর লক্ষণগুলি হ'ল শুষ্কতা এবং ত্বকের ম্লানতা, শ্লেষ্মা ঝিল্লি।
- উগ্রপন্থী ফোলা একটি কম প্লাজমা প্রোটিন সামগ্রী জল-লবণের ভারসাম্যকে বাড়িয়ে তোলে। পাতাল ফ্যাট গোড়ালি এবং গোড়ালি মধ্যে তরল জমে।
- ক্ষত এবং abrasion দরিদ্র নিরাময়। "বিল্ডিং উপাদানের" অভাবের কারণে কোষ মেরামত বাধাগ্রস্ত হয়।
- সুগন্ধি এবং চুল ক্ষতি, নখের ভঙ্গুরতা। শুষ্ক ত্বক, এক্সফোলিয়েশন এবং পেরেক প্লেটের ক্র্যাকিংয়ের কারণে খুশকির উপস্থিতি প্রোটিনের অভাব সম্পর্কে শরীরের সবচেয়ে সাধারণ সংকেত। চুল এবং নখ ক্রমাগত বৃদ্ধি পাচ্ছে এবং তাত্ক্ষণিকভাবে এমন পদার্থের অভাবকে সাড়া দেয় যা বৃদ্ধি এবং ভাল অবস্থার প্রচার করে।
- অযৌক্তিক ওজন হ্রাস। কোনও আপাত কারণে কিলোগুলির অদৃশ্য হয়ে যাওয়া শরীরের পেশীর ভরজনিত কারণে প্রোটিনের অভাবের জন্য ক্ষতিপূরণ দেওয়ার প্রয়োজনের কারণে হয়।
- হৃৎপিণ্ড এবং রক্তনালীগুলির ব্যর্থতা, শ্বাসকষ্টের উপস্থিতি। শ্বাসযন্ত্র, হজম এবং জেনিটোরিওনারী সিস্টেমগুলিও অবনতি করছে। শারীরিক পরিশ্রম ছাড়াই ডিসপেনিয়া দেখা দেয়, সর্দি-কাশি ও ভাইরাল রোগ ছাড়া কাশি রয়েছে।
এই জাতীয় উপসর্গের উপস্থিতির সাথে সাথে, আপনার তাত্ক্ষণিকভাবে খাদ্যের নিয়ম এবং মান পরিবর্তন করা উচিত, আপনার জীবনযাত্রায় পুনর্বিবেচনা করা উচিত এবং যদি ক্রমবর্ধমান হয় তবে একজন ডাক্তারের সাথে পরামর্শ করুন।
অনুকরণের জন্য কত প্রোটিনের প্রয়োজন
প্রতিদিন ব্যবহারের হার বয়স, লিঙ্গ, কাজের ধরণের উপর নির্ভর করে। মানদণ্ডের ডেটা সারণীতে উপস্থাপিত হয় (নীচে) এবং সাধারণ ওজনের জন্য ডিজাইন করা হয়।
কয়েকবার প্রোটিন গ্রহণ খাওয়া alচ্ছিক। প্রত্যেকে নিজের জন্য একটি সুবিধাজনক ফর্ম নির্ধারণ করে, প্রধান জিনিস হ'ল দৈনিক ভোজনের হার বজায় রাখা।
| শ্রম কার্যকলাপ + |
শারীরিক ক্রিয়াকলাপ
খাবারে উচ্চ প্রোটিন সামগ্রী
প্রোটিনযুক্ত খাবার স্বীকৃত:
সমস্ত জাতের মাংসের মধ্যে, পোল্ট্রি উপাদানের পরে প্রথম স্থানটি গরুর মাংস হবে: 18.9 গ্রাম তার পরে, শুয়োরের মাংস: 16.4 গ্রাম, মেষশাবক: 16.2 গ্রাম।
সীফুড এবং স্কুইড নেতারা: 18.0 গ্রাম g
প্রোটিনের জন্য ধনীতম মাছ হ'ল সালমন: 21.8 গ্রাম, তারপরে গোলাপী সালমন: 21 গ্রাম, জেন্ডার: 19 গ্রাম, ম্যাকেরেল: 18 গ্রাম, হারিং: 17.6 গ্রাম এবং কোড: 17.5 গ্রাম।
দুগ্ধজাত পণ্যগুলির মধ্যে, কেফির এবং টক ক্রিম দৃly়ভাবে অবস্থানটি ধরে রাখে: 3.0 গ্রাম, তারপরে দুধ: 2.8 গ্রাম।
উচ্চ শস্য - হারকিউলিস: 13.1 গ্রাম, বাজরা: 11.5 গ্রাম, সুজি: 11.3 গ্রাম
আদর্শ জেনে এবং আর্থিক সুযোগগুলি বিবেচনায় নিয়ে, আপনি সঠিকভাবে একটি মেনু রচনা করতে পারেন এবং এটিতে চর্বি এবং শর্করা যুক্ত করতে নিশ্চিত হন sure
পুষ্টিতে প্রোটিনের অনুপাত
স্বাস্থ্যকর ডায়েটে প্রোটিন, চর্বি, শর্করাগুলির অনুপাত 1: 1: 4 হওয়া উচিত। স্বাস্থ্যকর খাবারের ভারসাম্যের মূল চাবিকাঠি অন্য উপায়ে উপস্থাপন করা যায়: প্রোটিন 25-35%, চর্বি 25-35%, শর্করা 30-50%।
একই সময়ে, চর্বিগুলি দরকারী হওয়া উচিত: জলপাই বা তিসি তেল, বাদাম, মাছ, পনির।
একটি প্লেটে থাকা কার্বোহাইড্রেট হ'ল হার্ড পাস্তা, যে কোনও তাজা শাকসব্জী পাশাপাশি ফল / শুকনো ফল, টক-দুধজাতীয় পণ্য।
অংশগুলিতে থাকা প্রোটিনগুলি বিকল্পভাবে একত্রিত হতে পারে: উদ্ভিজ্জ + প্রাণী।
প্রোটিনযুক্ত এমিনো অ্যাসিডগুলি
বিনিময়যোগ্য শরীর নিজেই সংশ্লেষিত হতে পারে, তবে বাইরে থেকে তাদের সরবরাহ কখনও অতিরিক্ত অতিরিক্ত হয় না। বিশেষত একটি সক্রিয় জীবনধারা এবং দুর্দান্ত শারীরিক পরিশ্রম সহ।
ব্যতিক্রম ব্যতীত সমস্ত গুরুত্বপূর্ণ, এর মধ্যে সবচেয়ে জনপ্রিয়:
ক্ষারযুক্ত।
এটি কার্বোহাইড্রেটের বিপাককে উদ্দীপিত করে, টক্সিন নির্মূল করতে সহায়তা করে। "পরিষ্কার" জন্য দায়ী। মাংস, মাছ, দুগ্ধজাত সামগ্রীতে উচ্চ সামগ্রী।
arginine.
এটি কোনও পেশী, স্বাস্থ্যকর ত্বক, কার্টিলেজ এবং জয়েন্টগুলি চুক্তি করা প্রয়োজন। ফ্যাট বার্ন এবং ইমিউন সিস্টেমের কার্যকারিতা সরবরাহ করে। এটি কোনও মাংস, দুধ, কোনও বাদাম, জেলটিনে রয়েছে।
অ্যাস্পার্টিক অ্যাসিড।
শক্তি ভারসাম্য সরবরাহ করে। কেন্দ্রীয় স্নায়ুতন্ত্রের কার্যকারিতা উন্নত করে। ভাল গরুর মাংস এবং মুরগির থালা - বাসন, দুধ, বেত চিনি শক্তি সম্পদ পূরণ করুন। আলু, বাদাম, সিরিয়ালযুক্ত।
Histidine।
শরীরের প্রধান "নির্মাতা" হিস্টামিন এবং হিমোগ্লোবিনে রূপান্তরিত হয়। দ্রুত ক্ষত নিরাময়ে, বৃদ্ধি প্রক্রিয়া জন্য দায়ী। তুলনামূলকভাবে দুধ, সিরিয়াল এবং যে কোনও মাংসে।
Serine।
নিউরোট্রান্সমিটার, মস্তিষ্ক এবং কেন্দ্রীয় স্নায়ুতন্ত্রের সুস্পষ্ট কার্যকারিতার জন্য অপরিহার্য। এখানে চিনাবাদাম, মাংস, সিরিয়াল, সয়া রয়েছে।
সঠিক পুষ্টি এবং সঠিক জীবনযাপনের সাথে, সমস্ত অ্যামিনো অ্যাসিডগুলি "কিউব" সংশ্লেষণ এবং স্বাস্থ্য, সৌন্দর্য এবং দীর্ঘায়ু মডেলিংয়ের জন্য শরীরে উপস্থিত হবে।
শরীরে প্রোটিনের ঘাটতি কিসের কারণে ঘটে
- ঘন ঘন সংক্রামক রোগ, প্রতিরোধ ব্যবস্থা দুর্বল করে দেওয়া।
- চাপ এবং উদ্বেগ।
- সমস্ত বিপাকীয় প্রক্রিয়া বৃদ্ধ এবং ধীর হয়ে যাওয়া।
- স্বতন্ত্র ওষুধের ব্যবহারের একটি পার্শ্ব প্রতিক্রিয়া।
- পাচনতন্ত্রের ব্যর্থতা।
- আঘাত।
- ফাস্ট ফুড, তাত্ক্ষণিক পণ্য, নিম্ন মানের অর্ধ-সমাপ্ত পণ্যগুলির উপর ভিত্তি করে খাদ্য।
একক অ্যামিনো অ্যাসিডের ঘাটতি একটি নির্দিষ্ট প্রোটিনের উত্পাদন বন্ধ করে দেবে। শরীরটি "ভয়েডগুলি পূরণ করা" নীতির ভিত্তিতে সংগঠিত করা হয়েছে, সুতরাং অনুপস্থিত অ্যামিনো অ্যাসিডগুলি অন্যান্য প্রোটিন থেকে বের করা হবে। এই "পুনর্নির্মাণ" অঙ্গ, পেশী, হৃদয়, মস্তিষ্কের কার্যকারিতা ব্যাহত করে এবং পরবর্তীকালে এই রোগটিকে উস্কে দেয়।
শিশুদের মধ্যে প্রোটিনের ঘাটতি বৃদ্ধি বাধা দেয়, শারীরিক এবং মানসিক প্রতিবন্ধকতা সৃষ্টি করে।
রক্তাল্পতার বিকাশ, ত্বকের রোগের উপস্থিতি, হাড় এবং পেশী টিস্যুর প্যাথলজি রোগগুলির সম্পূর্ণ তালিকা নয়। মারাত্মক প্রোটিন ডিসট্রফির ফলে পাগলামি এবং কাওশিওরকোর হতে পারে (প্রোটিনের অভাবে মারাত্মক ডিসস্ট্রফি ধরণের).
প্রোটিন যখন শরীরের ক্ষতি করে
- অতিরিক্ত সংবর্ধনা
- লিভার, কিডনি, হার্ট এবং রক্তনালীগুলির দীর্ঘস্থায়ী রোগ
শরীর দ্বারা কোনও পদার্থের অসম্পূর্ণ শোষণের কারণে প্রায়শই ওভারসাপ্লি হয় না।যারা প্রশিক্ষক এবং পুষ্টিবিদদের পরামর্শ অনুসরণ না করে যত তাড়াতাড়ি সম্ভব পেশী বৃদ্ধি করতে চান তাদের ক্ষেত্রে এটি ঘটে।
"অতিরিক্ত" অভ্যর্থনাগুলির সমস্যাগুলির মধ্যে রয়েছে:
রেনাল ব্যর্থতা। অতিরিক্ত পরিমাণে প্রোটিন ওভারলোড অঙ্গগুলি, তাদের প্রাকৃতিক ক্রিয়াকে ব্যাহত করে। "ফিল্টার" লোড সহ্য করতে পারে না, কিডনি রোগ দেখা দেয়।
লিভার ডিজিজ অতিরিক্ত প্রোটিন রক্তে অ্যামোনিয়া জমা করে, যা লিভারের অবস্থার আরও খারাপ করে।
এথেরোস্ক্লেরোসিসের বিকাশ। বেশিরভাগ প্রাণীর পণ্যগুলিতে দরকারী পদার্থ ছাড়াও ক্ষতিকারক ফ্যাট এবং কোলেস্টেরল থাকে।
লিভার, কিডনি, কার্ডিওভাসকুলার এবং পাচনতন্ত্রের প্যাথলজিতে ভোগা লোকেদের প্রোটিন গ্রহণ সীমিত করা উচিত।
তাদের নিজের স্বাস্থ্যের যত্ন নেওয়ার জন্য যারা এগুলি নিয়ে চিন্তিত তাদের সুদর্শন দেওয়া হয়। মারাত্মক পরিণতি এড়াতে, আপনাকে পুনরুদ্ধারের জন্য শরীরের প্রয়োজনীয়তাটি মনে রাখতে হবে। একটি সম্পূর্ণ বিশ্রাম, পুষ্টি, পরিদর্শন বিশেষজ্ঞরা তারুণ্য, স্বাস্থ্য এবং জীবনকে দীর্ঘায়িত করবে।
দ্রাব্যতা
জলে দ্রবণীয়তায় প্রোটিনগুলি পৃথক হয়। জল দ্রবণীয় প্রোটিনগুলিকে অ্যালবামিন বলা হয়, এর মধ্যে রক্ত এবং দুধের প্রোটিন অন্তর্ভুক্ত। অদ্রবণীয় বা স্ক্লেরোপ্রোটিনগুলির মধ্যে উদাহরণস্বরূপ কেরাতিন (প্রোটিন যা চুল, স্তন্যপায়ীদের চুল, পাখির পালক ইত্যাদি) এবং ফাইব্রোইন অন্তর্ভুক্ত করে, যা রেশম এবং কোব্বের অংশ। একটি প্রোটিনের দ্রবণীয়তা কেবল তার গঠন দ্বারা নয়, তবে দ্রাবকের প্রকৃতি, আয়নিক শক্তি এবং সমাধানের পিএইচ হিসাবে বাহ্যিক কারণগুলি দ্বারা নির্ধারিত হয়।
প্রোটিনগুলি হাইড্রোফিলিক (জল-দ্রবণীয়) এবং হাইড্রোফোবিক (জল-নিরোধক) এ বিভক্ত। সাইটোপ্লাজম, নিউক্লিয়াস এবং আন্তঃকোষীয় পদার্থের বেশিরভাগ প্রোটিন হ'ল অদ্রবণীয় কেরাতিন এবং ফাইব্রোইন হাইড্রোফিলিক। জৈবিক ঝিল্লি তৈরির বেশিরভাগ প্রোটিন হাইড্রোফোবিক - অবিচ্ছেদ্য ঝিল্লি প্রোটিন যা ঝিল্লির হাইড্রোফোবিক লিপিডগুলির সাথে যোগাযোগ করে (এই প্রোটিনগুলি একটি নিয়ম হিসাবে হাইড্রোফিলিক সাইটও রয়েছে)।
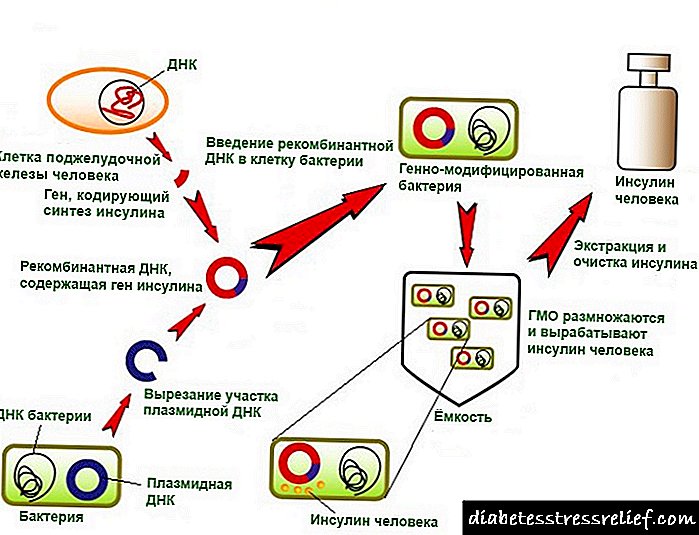
দেহে প্রোটিন বায়োসিন্থেসিস
প্রোটিন বায়োসিন্থেসিস - একটি বিশেষ ধরণের রাসায়নিক বন্ধনের সাথে মিশ্রিত করে অ্যামিনো অ্যাসিড থেকে কাঙ্ক্ষিত প্রোটিনগুলির দেহে গঠন - পলিপেপটাইড চেইন। ডিএনএ প্রোটিন কাঠামোর তথ্য সঞ্চয় করে। সংশ্লেষটি নিজেই কোষের একটি বিশেষ অংশে স্থান পায় যা রাইবোসোম নামে পরিচিত। আরএনএ পছন্দসই জিন (ডিএনএ সাইট) থেকে রাইবোসোমে তথ্য স্থানান্তর করে।
যেহেতু প্রোটিন জৈব সংশ্লেষ বহুবিধ, জটিল, মানব অস্তিত্বের ভিত্তিতে নির্ধারিত তথ্যগুলি ব্যবহার করে - ডিএনএ, তাই এর রাসায়নিক সংশ্লেষণ একটি কঠিন কাজ। বিজ্ঞানীরা কীভাবে কিছু নির্দিষ্ট এনজাইম এবং হরমোনগুলির প্রতিরোধকারীগুলি গ্রহণ করতে শিখেছেন, তবে জেনেটিক ইঞ্জিনিয়ারিং ব্যবহার করে প্রোটিন গ্রহণ করা সবচেয়ে গুরুত্বপূর্ণ বৈজ্ঞানিক কাজ।

পরিবহন
একটি বিশেষ রক্ত প্রোটিনের পরিবহন কার্য - হিমোগ্লোবিন। এই প্রোটিনের জন্য ধন্যবাদ, অক্সিজেন ফুসফুস থেকে শরীরের অঙ্গ এবং টিস্যুতে সরবরাহ করা হয়।
এটি অ্যান্টিবডি নামক ইমিউন সিস্টেমের প্রোটিনগুলির ক্রিয়াকলাপের সাথে জড়িত। এটি অ্যান্টিবডি যা শরীরের স্বাস্থ্য রক্ষা করে, এটি ব্যাকটিরিয়া, ভাইরাস, বিষ থেকে রক্ষা করে এবং রক্তকে একটি খোলা ক্ষতের জায়গায় জমাট বাঁধার অনুমতি দেয়।
প্রোটিনের সংকেত ফাংশন হ'ল কোষগুলির মধ্যে সংকেত (তথ্য) প্রেরণ করা।
বয়স্কদের জন্য প্রোটিনের মান
প্রোটিনের জন্য মানব দেহের প্রয়োজনীয়তা সরাসরি তার শারীরিক ক্রিয়াকলাপের উপর নির্ভর করে। আমরা যত বেশি স্থানান্তরিত করি তত দ্রুত আমাদের শরীরে সমস্ত বায়োকেমিক্যাল বিক্রিয়াগুলি এগিয়ে যায়। নিয়মিত অনুশীলনকারীদের গড় ব্যক্তির চেয়ে প্রায় দ্বিগুণ প্রোটিনের প্রয়োজন হয়। খেলাধুলায় জড়িত ব্যক্তিদের জন্য প্রোটিনের অভাব পুরো শরীরের পেশী এবং ক্লান্তি বিপজ্জনক "শুকিয়ে যাওয়া"!
গড়ে, একজন প্রাপ্তবয়স্কের জন্য প্রোটিনের আদর্শটি 1 কেজি ওজনের প্রতি 1 গ্রাম প্রোটিনের সহগের ভিত্তিতে গণনা করা হয়, যা পুরুষদের জন্য প্রায় 80-100 গ্রাম, মহিলাদের জন্য 55-60 গ্রাম। পুরুষ অ্যাথলিটদের প্রতি দিন 170-200 গ্রাম খাওয়ার প্রোটিনের পরিমাণ বাড়ানোর পরামর্শ দেওয়া হয়।

শরীরের জন্য সঠিক প্রোটিন পুষ্টি
প্রোটিনের সাথে শরীরকে পরিপূর্ণ করার জন্য সঠিক পুষ্টি হ'ল প্রাণী এবং উদ্ভিদ প্রোটিনের সংমিশ্রণ। খাদ্য থেকে প্রোটিনের একীকরণের ডিগ্রি তার উত্স এবং তাপ চিকিত্সার পদ্ধতির উপর নির্ভর করে।
সুতরাং, প্রাণী প্রোটিনের মোট খাওয়ার প্রায় 80% এবং উদ্ভিজ্জ প্রোটিনের 60% শরীর দ্বারা শোষিত হয়। উদ্ভিদের তুলনায় প্রাণিজ উত্সের পণ্যগুলিতে পণ্যটির ইউনিট ভরতে প্রোটিনের পরিমাণ বেশি থাকে। তদ্ব্যতীত, "প্রাণী" পণ্যগুলির রচনায় সমস্ত অ্যামিনো অ্যাসিড অন্তর্ভুক্ত রয়েছে এবং এই ক্ষেত্রে উদ্ভিদ পণ্যগুলি নিকৃষ্ট বলে বিবেচিত হয়।
উন্নত প্রোটিন শোষণের জন্য বেসিক পুষ্টির নিয়ম:
- রান্না করার একটি মৃদু উপায় - রান্না, বাষ্প, স্টিউইং। ফ্রাইংয়ের বিষয়টি উড়িয়ে দেওয়া উচিত।
- এটি আরও মাছ এবং হাঁস খাওয়ার পরামর্শ দেওয়া হয়। আপনি যদি সত্যিই মাংস চান, তবে গরুর মাংস পছন্দ করুন।
- ঝোলগুলি ডায়েট থেকে বাদ দেওয়া উচিত, এগুলি চর্বিযুক্ত এবং ক্ষতিকারক। চরম ক্ষেত্রে, আপনি "গৌণ ব্রোথ" ব্যবহার করে প্রথম থালা রান্না করতে পারেন।
পেশী বৃদ্ধির জন্য প্রোটিন পুষ্টির বৈশিষ্ট্য
ক্রীড়াবিদ যারা সক্রিয়ভাবে পেশী ভর অর্জন করছে উপরোক্ত সমস্ত সুপারিশ মেনে চলতে হবে। তাদের ডায়েটের বেশিরভাগটি প্রাণী উত্সের প্রোটিন হওয়া উচিত। এগুলিকে উদ্ভিজ্জ প্রোটিন পণ্যগুলির সাথে একত্রে খাওয়া উচিত, যার মধ্যে সয়া একটি বিশেষ পছন্দ।
এটি একটি চিকিত্সকের সাথে পরামর্শ এবং বিশেষ প্রোটিন পানীয় ব্যবহার বিবেচনা করা প্রয়োজন, প্রোটিন শোষণের শতাংশ 97-98%। বিশেষজ্ঞ স্বতন্ত্রভাবে একটি পানীয় নির্বাচন করবেন, সঠিক ডোজ গণনা করুন। এটি শক্তি প্রশিক্ষণের জন্য একটি মনোজ্ঞ এবং দরকারী প্রোটিন পরিপূরক হবে।
Denaturation
প্রোটিন বিচ্ছিন্নতা তার জৈবিক ক্রিয়াকলাপ এবং / অথবা চতুষ্কোণ, তৃতীয় বা গৌণ কাঠামোর ("প্রোটিন কাঠামো" বিভাগটি দেখুন) এর সাথে যুক্ত শারীরিক রাসায়নিক বৈশিষ্ট্যের কোনও পরিবর্তনকে বোঝায়। একটি নিয়ম হিসাবে, প্রোটিনগুলি সেই পরিস্থিতিতে (তাপমাত্রা, পিএইচ, ইত্যাদি) এর অধীনে বেশ স্থিতিশীল থাকে যেখানে তারা সাধারণত শরীরে কাজ করে। এই পরিস্থিতিতে একটি তীব্র পরিবর্তন প্রোটিন স্বল্পতা বাড়ে। ডিএনটরিং এজেন্টের প্রকৃতির উপর নির্ভর করে যান্ত্রিক (শক্তিশালী আলোড়ন বা কাঁপানো), শারীরিক (হিটিং, কুলিং, ইরেডিয়েশন, সোনিকেশন) এবং রাসায়নিক (অ্যাসিড এবং ক্ষারক, সারফ্যাক্ট্যান্টস, ইউরিয়া) অস্বচ্ছতা পৃথক করা হয়।
প্রোটিন বিচ্ছিন্নতা সম্পূর্ণ বা আংশিক, বিপরীত পরিবর্তনযোগ্য বা অপরিবর্তনীয় হতে পারে। প্রতিদিনের জীবনে অপরিবর্তনীয় প্রোটিন ড্যানোটারেশনের সবচেয়ে বিখ্যাত ক্ষেত্রে একটি মুরগির ডিম প্রস্তুত করা হয়, যখন, উচ্চ তাপমাত্রার প্রভাবে, জল দ্রবণীয় স্বচ্ছ প্রোটিন ওভালবামিন ঘন, দ্রবীভূত এবং অস্বচ্ছ হয়ে যায়। অ্যামোনিয়াম সল্ট (সল্ট আউট পদ্ধতি) ব্যবহার করে জল দ্রবণীয় প্রোটিনের বৃষ্টিপাতের ক্ষেত্রে যেমন কিছু ক্ষেত্রে অবনতি হয় তেমন পরিবর্তন হয় এবং এই পদ্ধতিটি তাদের পরিষ্কার করার উপায় হিসাবে ব্যবহৃত হয়।
প্রোটিন অণুগুলি লিনিয়ার পলিমার যা α-L-অ্যামিনো অ্যাসিডের (যা মনোমার) থাকে এবং এটি অ্যামিনো অ্যাসিডের অবশিষ্টাংশ এবং অ-অ্যামিনো অ্যাসিড প্রকৃতির উপাদানগুলিকে প্রোটিনের সংমিশ্রণে অন্তর্ভুক্ত করতে পারে। বৈজ্ঞানিক সাহিত্যে, এক বা তিন-বর্ণের সংক্ষিপ্তসারগুলি অ্যামিনো অ্যাসিডগুলি উল্লেখ করতে ব্যবহৃত হয়। যদিও প্রথম নজরে এটি মনে হতে পারে যে বেশিরভাগ প্রোটিনে "কেবল" 20 ধরণের অ্যামিনো অ্যাসিডের ব্যবহার প্রোটিনের কাঠামোর বৈচিত্র্যকে সীমাবদ্ধ করে, বাস্তবে, বিকল্পগুলির সংখ্যা খুব কমই বিবেচনা করা যেতে পারে: 5 এমিনো অ্যাসিডের অবশিষ্টাংশগুলির একটি শৃঙ্খলার জন্য, এটি ইতিমধ্যে 3 মিলিয়নেরও বেশি, এবং 100 এমিনো অ্যাসিডের অবশিষ্টাংশের একটি শৃঙ্খল (ছোট প্রোটিন) 10,130 টিরও বেশি রূপগুলিতে উপস্থাপিত হতে পারে। দৈর্ঘ্যে 2 থেকে কয়েক দশক পর্যন্ত অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলিকে প্রায়শই বলা হয় peptides, আরও বহুগুণ পলিমারাইজেশন সহ - প্রোটিনযদিও এই বিভাগটি খুব স্বেচ্ছাচারী।
যখন একটি protein-অ্যামিনো গ্রুপ (-NH) এর সাথে একটি এমিনো অ্যাসিডের α-carboxyl গ্রুপ (-COOH) এর মিথস্ক্রিয়ার ফলাফল হিসাবে একটি প্রোটিন গঠিত হয়2) অন্য অ্যামিনো অ্যাসিডের পেপটাইড বন্ধন গঠিত হয়। প্রোটিনের প্রান্তগুলিকে বলা হয় এন- এবং সি-টার্মিনাস, টার্মিনালের অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলির মধ্যে কোনটি নিখরচায় তার উপর নির্ভর করে: -NH2 বা -COOH যথাক্রমে। রাইবোসোমে প্রোটিন সংশ্লেষণে, প্রথম (এন-টার্মিনাল) অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলি সাধারণত মেথিওনিন অবশিষ্টাংশ হয়, এবং পরবর্তী অংশগুলি পূর্ববর্তী সি-টার্মিনাসের সাথে সংযুক্ত থাকে।
প্রোটিন পুষ্টির বৈশিষ্ট্য, ডায়েটার
যাঁরা ওজন কমাতে চান তাদের পশুর এবং উদ্ভিজ্জ প্রোটিন পণ্য খাওয়া উচিত। তাদের গ্রহণের বিষয়টি আলাদা করা গুরুত্বপূর্ণ, কারণ তাদের আত্তীকরণের সময়টি আলাদা। চর্বিযুক্ত মাংসের পণ্যগুলি ফেলে দেওয়া উচিত, আলুগুলিকে অপব্যবহার করা উচিত নয়, গড় প্রোটিন সামগ্রীযুক্ত সিরিয়ালগুলি পছন্দ করা উচিত।
প্রোটিন ডায়েটে চরমপন্থায় না গিয়ে "বসুন"। এটি সবার পক্ষে উপযুক্ত নয়, কারণ কার্বোহাইড্রেটগুলির সম্পূর্ণ বর্জন কার্যকারিতা এবং শক্তি হ্রাস করতে পারে। সকালে কার্বোহাইড্রেটযুক্ত খাবার খাওয়ার পক্ষে এটি যথেষ্ট - এটি দিনের বেলা শক্তি দেয়, বিকেলে প্রোটিন কম চর্বিযুক্ত খাবার খান। সন্ধ্যায় শক্তির অভাব তৈরি করতে, শরীর শরীরের ফ্যাট পোড়াতে শুরু করবে, তবে এই প্রক্রিয়া শরীরের স্বাস্থ্যের জন্য নিরাপদ হবে।
আপনার ডায়েটে সঠিক এবং সঠিকভাবে প্রস্তুত প্রোটিনযুক্ত খাবারগুলি অন্তর্ভুক্ত করার বিষয়ে নিশ্চিত হন। শরীরের জন্য, প্রোটিন মূল বিল্ডিং উপাদান! একসাথে নিয়মিত প্রশিক্ষণের সাথে, এটি আপনাকে একটি সুন্দর অ্যাথলেটিক শরীর তৈরি করতে সহায়তা করবে!
প্রোটিনগুলি হ'ল সর্বাধিক গুরুত্বপূর্ণ রাসায়নিক যৌগ, যা ছাড়া শরীরের গুরুত্বপূর্ণ কাজটি করা অসম্ভব। প্রোটিনগুলি এনজাইম, অঙ্গগুলির কোষ, টিস্যু নিয়ে গঠিত। এগুলি মানবদেহে বিপাক, পরিবহন এবং অন্যান্য অনেক প্রক্রিয়াগুলির জন্য দায়ী। প্রোটিনগুলি "রিজার্ভে" জমা করতে পারে না, তাই তাদের অবশ্যই নিয়মিত খাওয়াতে হবে be প্রোটিনগুলি নিয়ন্ত্রিত হওয়ার কারণে খেলাধুলায় জড়িত লোকদের জন্য এগুলি বিশেষ গুরুত্ব দেয়।
সংস্থার স্তরসমূহ

কে। লিন্ড্রস্টম-ল্যাং প্রোটিনের কাঠামোগত সংস্থার ৪ টি স্তরের পার্থক্য করার প্রস্তাব করেছিলেন: প্রাথমিক, মাধ্যমিক, তৃতীয় এবং চতুর্মুখী কাঠামো। যদিও এই বিভাগটি কিছুটা পুরানো হলেও এটি ব্যবহার অব্যাহত রয়েছে। পলিপপটিডের প্রাথমিক কাঠামো (অ্যামিনো অ্যাসিডের অবশিষ্টাংশের ক্রম) এর জিন এবং জেনেটিক কোডের কাঠামো দ্বারা নির্ধারিত হয় এবং প্রোটিন ভাঁজ করার সময় উচ্চতর আদেশের কাঠামো গঠিত হয়। যদিও সামগ্রিকভাবে প্রোটিনের স্থানিক কাঠামোটি তার অ্যামিনো অ্যাসিডের ক্রম দ্বারা নির্ধারিত হয় তবে এটি যথেষ্ট পরিশ্রমী এবং এটি বাহ্যিক অবস্থার উপর নির্ভর করতে পারে, তাই পছন্দের বা সবচেয়ে শক্তিশালীভাবে অনুকূল প্রোটিন গঠনের বিষয়ে কথা বলা আরও সঠিক।
প্রাথমিক কাঠামো

প্রাথমিক কাঠামোটি পলিপপটিড চেইনে অ্যামিনো অ্যাসিডের অবশিষ্টাংশের ক্রম। একটি প্রোটিনের প্রাথমিক কাঠামোটি সাধারণত অ্যামিনো অ্যাসিডের অবশিষ্টাংশের জন্য একক বা তিনটি বর্ণচিহ্ন ব্যবহার করে বর্ণনা করা হয়।
প্রাথমিক কাঠামোর গুরুত্বপূর্ণ বৈশিষ্ট্যগুলি হ'ল রক্ষণশীল মোটিফ - অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলির স্থিতিশীল সংমিশ্রণ যা একটি নির্দিষ্ট কার্য সম্পাদন করে এবং অনেকগুলি প্রোটিনে পাওয়া যায়। প্রজাতির বিবর্তনের সময় রক্ষণশীল মোটিভগুলি সংরক্ষণ করা হয়; তাদের কাছ থেকে অজানা প্রোটিনের কার্যকারিতা সম্পর্কে প্রায়শই ধারণা করা সম্ভব হয়। বিভিন্ন জীবের প্রোটিনের অ্যামিনো অ্যাসিড অনুক্রমের হোমোলজির ডিগ্রি (সাদৃশ্য) এর মাধ্যমে এই জীবগুলির অন্তর্ভুক্ত ট্যাক্সের মধ্যে বিবর্তনীয় দূরত্ব নির্ধারণ করা যায়।
প্রোটিনের প্রাথমিক কাঠামো প্রোটিন সিকোয়েন্সিং পদ্ধতি দ্বারা বা জেনেটিক কোড টেবিল ব্যবহার করে এর এমআরএনএর প্রাথমিক কাঠামো দ্বারা নির্ধারণ করা যেতে পারে।
মাধ্যমিক কাঠামো
গৌণ কাঠামো হাইড্রোজেন বন্ড দ্বারা স্থিতিশীল একটি পলিপেপটাইড চেইনের একটি খণ্ডের স্থানীয় ক্রম।নিম্নলিখিত গৌণ প্রোটিন কাঠামোর সর্বাধিক সাধারণ ধরণের:
- helic-হেলিকেলগুলি অণুর দীর্ঘ অক্ষের চারপাশে ঘন বাঁক হয়। একটি পালা হ'ল অ্যামিনো অ্যাসিডের অবশিষ্টাংশ, হেলিক্স পিচটি 0.54 এনএম (0.15 এনএম একটি এমিনো অ্যাসিডের অবশিষ্টাংশে পড়ে)। সর্পিলটি এইচ এবং ও পেপটাইড গ্রুপগুলির মধ্যে হাইড্রোজেন বন্ধন দ্বারা স্থিতিশীল হয়, ব্যবধানে 4 ইউনিট পৃথক করে। যদিও li-helix হয় বাম-হাত বা ডান-হাত হতে পারে, ডান-হাত প্রোটিনে প্রাধান্য দেয়। সর্পিল গ্লুটামিক অ্যাসিড, লাইসিন, আর্গিনিনের ইলেক্ট্রোস্ট্যাটিক মিথস্ক্রিয়া দ্বারা ব্যাহত হয়। একে অপরের কাছাকাছি, অ্যাসপ্রেজিন, সেরিন, থ্রোনিন এবং লিউসিনের অবশিষ্টাংশগুলি হেলিক্স গঠনে জীবাণুভাবে হস্তক্ষেপ করতে পারে, দীর্ঘস্থায়ী अवशेषগুলি শৃঙ্খলা নমন করে এবং α-হেলিক্সগুলিকে ব্যাহত করে,
- ets-শীটগুলি (ভাঁজ করা স্তরগুলি) বেশ কয়েকটি জিগজ্যাগ পলিপেপটাইড চেইন যেখানে হাইড্রোজেন বন্ধনগুলি প্রাথমিক কাঠামোর তুলনায় তুলনামূলকভাবে দূরবর্তী অ্যামিনো অ্যাসিডের (0.34 এনএম প্রতি এমিনো অ্যাসিডের অবশিষ্টাংশ) এর মধ্যে গঠিত হয় (আলাদাভাবে প্রোটিনের পরিবর্তে, যেমনটি ক্ষেত্রে রয়েছে) α-helix এ থাকুন)। এই চেইনগুলি সাধারণত এন-প্রান্তগুলি দ্বারা বিপরীত দিকগুলিতে (অ্যান্টিপ্যাপারালাল ওরিয়েন্টেশন) বা একদিকে (সমান্তরাল structure-কাঠামো) দ্বারা পরিচালিত হয়। সমান্তরাল এবং অ্যান্টিপ্যারালাল β-কাঠামো সমন্বিত একটি মিশ্র β-কাঠামোর অস্তিত্বও এটি সম্ভব। Β-শিটগুলি গঠনের জন্য, অ্যামিনো অ্যাসিডের পার্শ্ব গ্রুপগুলির ছোট আকারগুলি গুরুত্বপূর্ণ, সাধারণত গ্লাইসিন এবং অ্যালানাইন প্রবাহিত হয়,
- π-হেলিক্স,
- 310হেলিক্স,
- আনর্ডারড টুকরো
তৃতীয় স্তর

তৃতীয় স্তরটি হ'ল পলিপপটিড চেইনের স্থানিক কাঠামো। কাঠামোগতভাবে, এটিতে বিভিন্ন ধরণের মিথস্ক্রিয়া দ্বারা স্থিতিশীল একটি গৌণ কাঠামোর উপাদান থাকে যার মধ্যে হাইড্রোফোবিক মিথস্ক্রিয়া গুরুত্বপূর্ণ ভূমিকা পালন করে। তৃতীয় স্তর কাঠামোর স্থায়িত্ব জড়িত:
- কোভ্যালেন্ট বন্ড (দুটি সিস্টিনের অবশিষ্টাংশের মধ্যে - ডিসালফাইড ব্রিজ),
- অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলির বিপরীতভাবে চার্জ করা সাইড গ্রুপগুলির মধ্যে আয়নিক বন্ধন,
- হাইড্রোজেন বন্ড
- হাইড্রোফোবিক ইন্টারঅ্যাকশন। আশেপাশের জলের অণুগুলির সাথে যোগাযোগের সময়, প্রোটিনের অণুগুলি এমনভাবে ভাঁজ করা হয় যাতে অ্যামিনো অ্যাসিডের নন-পোলার পার্শ্ব গ্রুপগুলি জলীয় দ্রবণ থেকে বিচ্ছিন্ন হয় এবং পোলার হাইড্রোফিলিক পার্শ্ব গ্রুপগুলি অণুর পৃষ্ঠে প্রদর্শিত হয়।
প্রোটিন ভাঁজ নীতিগুলির অধ্যয়নগুলি দেখিয়েছে যে গৌণ কাঠামোর স্তর এবং পারমাণবিক স্থানিক কাঠামোর মধ্যে আরেকটি স্তর পার্থক্য করা সুবিধাজনক - ভাঁজ মোটিফ (আর্কিটেকচার, কাঠামোগত মোটিফ)। স্টাইলিং মোটিফ প্রোটিন ডোমেনের মধ্যে সেকেন্ডারি স্ট্রাকচার উপাদানগুলির (α-হেলিকেলস এবং β-strands) পারস্পরিক বিন্যাস দ্বারা নির্ধারিত হয় - একটি কমপ্যাক্ট গ্লোবুল যা নিজে নিজেই উপস্থিত থাকতে পারে বা অন্যান্য ডোমেনের সাথে বৃহত্তর প্রোটিনের অংশ হতে পারে। উদাহরণস্বরূপ, প্রোটিনগুলির গঠনের অন্যতম বৈশিষ্ট্য বিবেচনা করুন। চিত্রটিতে ডানদিকে দেখানো গ্লোবুলার প্রোটিনের একটি ing / β-সিলিন্ডার নামে একটি ভাঁজ মোটিফ রয়েছে: 8 সমান্তরাল stra-স্ট্র্যান্ড 8 α-হেলিকেলের সমন্বয়ে গঠিত অন্য সিলিন্ডারের ভিতরে একটি cyl-সিলিন্ডার গঠন করে। এই মোটিফটি প্রায় 10% প্রোটিনে পাওয়া যায়।
এটি পরিচিত যে স্টাইলিং মোটিফগুলি বেশ রক্ষণশীল এবং প্রোটিনে পাওয়া যায় যাগুলির কার্যকরী বা বিবর্তনমূলক সম্পর্ক নেই। স্টাইলিং উদ্দেশ্যগুলি নির্ধারণ প্রোটিনগুলির শারীরিক বা যৌক্তিক শ্রেণিবিন্যাসকে অন্তর্ভুক্ত করে (যেমন ক্যাথ বা এসসিওপি)।
প্রোটিনের স্থানিক কাঠামো নির্ধারণের জন্য, এক্স-রে বিচ্ছিন্ন বিশ্লেষণের পদ্ধতিগুলি, পারমাণবিক চৌম্বকীয় অনুরণন এবং কিছু ধরণের মাইক্রোস্কোপি ব্যবহার করা হয়।
চতুর্মুখী কাঠামো
কোয়ার্টারনারি স্ট্রাকচার (বা সাবুনিট, ডোমেন) হ'ল একক প্রোটিন কমপ্লেক্সের অংশ হিসাবে বেশ কয়েকটি পলিপপটিড চেইনের পারস্পরিক বিন্যাস।কোয়ার্টারনারি স্ট্রাকচারের সাথে প্রোটিন তৈরি করা প্রোটিন অণুগুলি পৃথকভাবে রাইবোসোমে গঠন করা হয় এবং সংশ্লেষণের পরে কেবল এগুলি একটি সাধারণ সুপার্রামোলিকুলার কাঠামো গঠন করে। একটি চতুষ্কোণ প্রোটিনে অভিন্ন এবং পৃথক উভয় পলিপপটিড চেইন থাকতে পারে। কোয়ার্টারি স্ট্রাকচারের স্থিতিশীলকরণের ক্ষেত্রে তৃতীয় স্তরের স্থিতিশীলতার মতো একই ধরণের মিথস্ক্রিয়া জড়িত। সুপারমোলিকুলার প্রোটিন কমপ্লেক্সগুলিতে কয়েক ডজন অণু থাকতে পারে।
বিল্ডিংয়ের ধরণ অনুসারে শ্রেণিবদ্ধকরণ
প্রোটিনগুলি সাধারণ ধরণের কাঠামো অনুসারে তিনটি গ্রুপে বিভক্ত করা যায়:
- ফাইব্রিলার প্রোটিন - পলিমার গঠন করে, তাদের গঠন সাধারণত অত্যন্ত নিয়মিত এবং মূলত বিভিন্ন চেইনের মধ্যে মিথস্ক্রিয়া দ্বারা সমর্থিত হয়। এগুলি মাইক্রোফিলামেন্টস, মাইক্রোটিউবুলস, ফাইব্রিলস গঠন করে এবং কোষ এবং টিস্যুগুলির গঠনকে সমর্থন করে। ফাইব্রিলার প্রোটিনের মধ্যে ক্যারেটিন এবং কোলাজেন অন্তর্ভুক্ত রয়েছে।
- গ্লোবুলার প্রোটিনগুলি জল দ্রবণীয়, অণুর সাধারণ ফর্মটি কমবেশি গোলাকার হয়।
- মেমব্রেন প্রোটিন - কোষের ঝিল্লি ছেদ করে এমন ডোমেন রয়েছে তবে তাদের কিছু অংশ ঝিল্লি থেকে আন্তঃকোষীয় পরিবেশ এবং কোষ সাইটোপ্লাজমে ছড়িয়ে পড়ে। মেমব্রেন প্রোটিনগুলি রিসেপ্টর হিসাবে কাজ করে, অর্থাৎ, তারা সংকেত প্রেরণ করে এবং বিভিন্ন পদার্থের ট্রান্সমেম্ব্রন পরিবহন সরবরাহ করে। প্রোটিন ট্রান্সপোর্টার সুনির্দিষ্ট, তাদের প্রত্যেকটি ঝিল্লি মাধ্যমে কেবলমাত্র নির্দিষ্ট অণু বা একটি নির্দিষ্ট ধরণের সংকেত পাস করে।
সাধারণ এবং জটিল প্রোটিন
পেপটাইড শৃঙ্খলা ছাড়াও অনেক প্রোটিনে অ অ্যামিনো অ্যাসিড গ্রুপ অন্তর্ভুক্ত থাকে এবং এই মাপদণ্ডের মাধ্যমে প্রোটিন দুটি বড় গ্রুপে বিভক্ত হয় - সাধারণ এবং জটিল প্রোটিন (প্রোটিন)। সাধারণ প্রোটিনগুলি কেবল পলিপেপটাইড শৃঙ্খলা নিয়ে গঠিত, জটিল প্রোটিনগুলিতে অ অ্যামিনো অ্যাসিড বা কৃত্রিম গ্রুপ থাকে। কৃত্রিম গ্রুপগুলির রাসায়নিক প্রকৃতির উপর নির্ভর করে নিম্নলিখিত শ্রেণিগুলি জটিল প্রোটিনগুলির মধ্যে আলাদা করা হয়:
- গ্লাইকোপ্রোটিনগুলি কোয়েলেটালি লিঙ্কযুক্ত কার্বোহাইড্রেট অবশিষ্টাংশগুলি একটি কৃত্রিম গ্রুপ হিসাবে, গ্লাইকোপ্রোটিনগুলি মিউকোপলাইস্যাকারাইডের অবশিষ্টাংশগুলি প্রোটোগ্লাইক্যানগুলির সাবক্লাসের অন্তর্গত। কার্বোহাইড্রেট অবশিষ্টাংশের সাথে বন্ধন গঠনে, সেরিন বা থ্রোনিনের হাইড্রোক্সাইল গ্রুপগুলি সাধারণত জড়িত থাকে। বেশিরভাগ এক্সট্রা সেলুলার প্রোটিনগুলি, বিশেষত ইমিউনোগ্লোবুলিনগুলিতে গ্লাইকোপ্রোটিন হয়। প্রোটোগ্লাইকান্সে, কার্বোহাইড্রেট অংশ হয়
প্রোটিন অণুর মোট ভর 95%, তারা আন্তঃকোষীয় ম্যাট্রিক্সের প্রধান উপাদান,
2. জীবের প্রজননের জৈবিক তাত্পর্য। প্রজনন পদ্ধতি।
1. প্রজনন এবং এর তাত্পর্য।
প্রজনন - অনুরূপ জীবের প্রজনন, যা সরবরাহ করে
বহু সহস্রাব্দের জন্য প্রজাতির অস্তিত্ব বৃদ্ধিতে অবদান রাখে
প্রজাতির ব্যক্তির সংখ্যা, জীবনের ধারাবাহিকতা। অযৌন, যৌন এবং
জীবের উদ্ভিদ প্রচার।
2. অযৌন প্রজনন সর্বাধিক প্রাচীন উপায়। দ্য
একটি জীব যৌনহীনতার সাথে জড়িত, যখন বেশিরভাগ ক্ষেত্রে যৌন অংশ নেয়
দুই ব্যক্তি। উদ্ভিদে, স্পোরস ব্যবহার করে অলৌকিক প্রজনন - একটি
বিশেষায়িত কক্ষ শৈবাল, শ্যাওলা, হর্সটেইল,
লুন্ঠন, ফার্ন গাছপালা থেকে বীজপাতার ফুসকুড়ি, তাদের অঙ্কুরোদগম এবং বিকাশ
তাদের অনুকূল পরিস্থিতিতে নতুন সহায়ক জীব। বিপুল সংখ্যার মৃত্যু
প্রতিকূল পরিস্থিতিতে পড়ে বিবাদ। সংঘটন হওয়ার সম্ভাবনা কম
বীজ থেকে নতুন জীব কারণ তারা কয়েকটি পুষ্টি এবং
চারা এগুলি প্রধানত পরিবেশ থেকে গ্রহণ করে।
3. উদ্ভিজ্জ বর্ধন - সঙ্গে গাছপালা প্রচার
উদ্ভিদ অঙ্গগুলি ব্যবহার করে: বায়ুযুক্ত বা ভূগর্ভস্থ অঙ্কুর, মূলের কিছু অংশ,
পাতা, কন্দ, বাল্ব একটি জীবের উদ্ভিদ প্রচারে অংশ নেওয়া
বা এর অংশগুলি। কন্যার স্নেহ মায়ের সাথে রোপণ, যেমন
মায়ের দেহের বিকাশ অব্যাহত রাখে। দুর্দান্ত দক্ষতা এবং
প্রকৃতির জীবজন্তু হিসাবে উদ্ভিদের বর্ধনের বিস্তার
মাতাল অংশ থেকে বীজের চেয়ে দ্রুত গঠিত উদ্ভিজ্জ উদাহরণ
প্রজনন: rhizomes ব্যবহার করে - উপত্যকার লিলি, পুদিনা, Wheatgrass, ইত্যাদি, মূলের
মাটি (লেয়ারিং) স্পর্শ করে নীচের শাখা - কারেন্টস, বন্য আঙ্গুর, গোঁফ
- স্ট্রবেরি, বাল্ব - টিউলিপ, ড্যাফোডিল, ক্রোকস। উদ্ভিজ্জ ব্যবহার
প্রজননকৃত উদ্ভিদের বৃদ্ধি যখন প্রজনন: আলু কন্দ দ্বারা প্রচারিত হয়,
বাল্ব - পেঁয়াজ এবং রসুন, লেয়ারিং - কারেন্টস এবং গসবেরি, রুট
অফস্রিং - চেরি, বরই, কাটিং - ফল গাছ।
4. যৌন প্রজনন যৌন প্রজননের সারমর্ম
জীবাণু কোষ (গ্যামেটস) গঠনে পুরুষ জীবাণু কোষের সংমিশ্রণ ঘটে
(শুক্রাণু) এবং মহিলা (ডিম) - গর্ভাধান এবং একটি নতুন বিকাশ
একটি নিষিক্ত ডিম থেকে একটি কন্যা জীব। নিষেকের জন্য ধন্যবাদ
ক্রোমোজোমের আরও বিচিত্র সেট সহ একটি সহায়ক জীব, যার অর্থ আরও বেশি
বিভিন্ন বংশগত বৈশিষ্ট্য, ফলস্বরূপ এটি হতে পারে
আরও আবাসস্থল। যৌন প্রজনন উপস্থিতি
শৈবাল, শ্যাওলা, ফার্ন, জিমনোস্পার্মস এবং অ্যাঞ্জিওস্পার্মস। জটিলতা
উদ্ভিদের মধ্যে তাদের বিবর্তনের সময় যৌন প্রক্রিয়া, সবচেয়ে জটিল উপস্থিতি
বীজ গাছপালা ফর্ম।
5. বীজের প্রচার বীজের সাহায্যে ঘটে,
এটি জিমোস্পার্মস এবং অ্যাঞ্জিওস্পার্মস (অ্যাঞ্জিওস্পার্মস) এর বৈশিষ্ট্য
উদ্ভিদ প্রচারও ব্যাপক) is পদক্ষেপের ক্রম
বীজ প্রচার: পরাগায়ন - একটি পিসিলের কলঙ্কে পরাগের স্থানান্তর, এর
অঙ্কুরোদগম, দুটি শুক্রাণুকে ভাগ করে উত্থান, তাদের অগ্রগতি
ডিম্বাশয়, তারপরে ডিমের সাথে একটি শুক্রাণুর সংশ্লেষণ এবং অন্যটি দিয়ে
মাধ্যমিক নিউক্লিয়াস (অ্যাঞ্জিওস্পার্মে) ডিম্বাশয় বীজ গঠন -
পুষ্টি সরবরাহের সাথে ভ্রূণ এবং ডিম্বাশয়ের দেয়াল থেকে - ভ্রূণ। বীজ -
একটি নতুন উদ্ভিদের জীবাণু, অনুকূল পরিস্থিতিতে, এটি অঙ্কুরিত হয় এবং প্রথমবার
চারা বীজের পুষ্টি দ্বারা খাওয়ানো হয়, এবং তারপরে এর শিকড়
কার্বন ডাই অক্সাইড - এবং মাটি থেকে জল এবং খনিজগুলি শুষে শুরু করুন absor
সূর্যালোক বাতাস থেকে গ্যাস। একটি নতুন উদ্ভিদের স্বাধীন জীবন।
প্রোটিন বায়োফিজিক্স
কোষে থাকা প্রোটিনের শারীরিক বৈশিষ্ট্যগুলি জলের ঝিল্লি এবং ম্যাক্রোমোলিকুলের ভিড়কে বিবেচনা করে (ইঞ্জি।) খুব জটিল আদেশযুক্ত "স্ফটিকের মতো সিস্টেম" হিসাবে প্রোটিনের অনুমান - একটি "অ্যাপিওরিওডিক স্ফটিক" - এক্স-রে বিচ্ছুরণ বিশ্লেষণ (1 অ্যাংস্ট্রোমের রেজোলিউশন পর্যন্ত), উচ্চ প্যাকিং ঘনত্ব, স্বচ্ছলতার প্রক্রিয়াটির সহযোগিতা এবং অন্যান্য সত্য দ্বারা সমর্থিত।
অন্য একটি অনুমানের পক্ষে, আন্তঃগ্লোবুলার নড়াচড়ার প্রক্রিয়াগুলিতে প্রোটিনগুলির তরল জাতীয় বৈশিষ্ট্যগুলি (সীমিত হপিং বা ক্রমাগত বিচ্ছুরণের মডেল) নিউট্রন ছড়িয়ে পড়া, ম্যাসবাউর বর্ণালী সম্পর্কিত পরীক্ষা-নিরীক্ষার দ্বারা প্রমাণিত হয়।

সর্বজনীন পদ্ধতি: রাইবোসোমাল সংশ্লেষণ
জিনে এনকোড করা তথ্যের ভিত্তিতে প্রোটিনগুলি অ্যামিনো অ্যাসিড থেকে জীবিত প্রাণীর দ্বারা সংশ্লেষিত হয়। প্রতিটি প্রোটিনে অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলির একটি অনন্য ক্রম থাকে, যা প্রোটিনকে এনকোডিং করে জিনের নিউক্লিওটাইড ক্রম দ্বারা নির্ধারিত হয়। জেনেটিক কোডটি ডিএনএর নিউক্লিওটাইড সিকোয়েন্সকে (আরএনএর মাধ্যমে) একটি পলিপেপটাইড শৃঙ্খলার অ্যামিনো অ্যাসিড অনুক্রমের অনুবাদ করার একটি পদ্ধতি। এই কোডটি আরএনএর ট্রিনুক্লিওটাইড বিভাগগুলির চিঠিপত্র নির্ধারণ করে, যাকে কোডন বলা হয় এবং প্রোটিনের অন্তর্ভুক্ত কিছু অ্যামিনো অ্যাসিড: এওজি নিউক্লিওটাইড ক্রম, উদাহরণস্বরূপ, মিথেনিনের সাথে মিলে যায়। যেহেতু ডিএনএ চার ধরণের নিউক্লিওটাইড সমন্বিত, সম্ভাব্য কোডনের মোট সংখ্যা 64৪, এবং যেহেতু ২০ টি এমিনো অ্যাসিড প্রোটিনে ব্যবহৃত হয়, তাই অনেকগুলি অ্যামিনো অ্যাসিড একাধিক কোডন দ্বারা নির্ধারিত হয়। তিনটি কোডন তাত্পর্যপূর্ণ: তারা পলিপপটিড চেইনের সংশ্লেষণের জন্য স্টপ সংকেত হিসাবে পরিবেশন করে এবং এগুলিকে টার্মিনেশন কোডন বা স্টপ কোডন বলে।
জিন এনকোডিং প্রোটিনগুলি প্রথমে আরএনএ পলিমেরেজ এনজাইম দ্বারা মেসেঞ্জার আরএনএ (এমআরএনএ) এর নিউক্লিয়োটাইড অনুক্রমে প্রতিলিপি করা হয়। সিংহভাগ ক্ষেত্রে জীবিত প্রাণীর প্রোটিনগুলি রাইবোসোমে সংশ্লেষিত হয় - কোষের সাইটোপ্লাজমে উপস্থিত মাল্টিকম্পোমেনডেন্ট মলিকুলার মেশিনগুলি। এমআরএনএ ম্যাট্রিক্সে রাইবোসোম দ্বারা পলিপপটিড চেইন সংশ্লেষনের প্রক্রিয়াটিকে অনুবাদ বলা হয়।
রিবোসোমাল প্রোটিন সংশ্লেষণ মূলত প্রোকারিওটস এবং ইউক্যারিওটসে একই, তবে কিছু বিবরণে পৃথক। সুতরাং, প্র্যাকেরিয়োটিক এমআরএনএ রাইবোসোমগুলি দ্বারা প্রতিলিখনের পরে বা তার সমাপ্তির আগেই প্রোটিনের অ্যামিনো অ্যাসিড অনুক্রমের মধ্যে পড়তে পারে। ইউক্যারিওটসে, প্রাথমিক ট্রান্সক্রিপ্টটি প্রথমে একটি ধারাবাহিক সংশোধন করতে হবে এবং অনুবাদ শুরু হওয়ার আগে সাইটোপ্লাজমে (রাইবোসোমের অবস্থানে) যেতে হবে। প্রোটারিওটসে প্রোটিন সংশ্লেষণের হার বেশি এবং প্রতি সেকেন্ডে 20 অ্যামিনো অ্যাসিডে পৌঁছতে পারে।

অনুবাদ শুরুর আগেই, অ্যামিনোসিল-টিআরএনএ সিন্থেটেজ এনজাইমগুলি নির্দিষ্টভাবে তাদের সম্পর্কিত ট্রান্সপোর্ট আরএনএ (টিআরএনএ) এর সাথে অ্যামিনো অ্যাসিড সংযুক্ত করে। অ্যান্টিকোডন নামে পরিচিত টিআরএনএর একটি অঞ্চল এমআরএনএ কোডনের সাথে পরিপূর্ণরূপে যুক্ত হতে পারে, যার ফলে জিনগত কোড অনুসারে পলিপপটিড শৃঙ্খলে টিআরএনএতে সংযুক্ত অ্যামিনো অ্যাসিডের অবশিষ্টাংশের অন্তর্ভুক্তি নিশ্চিত করা যায়।
অনুবাদ, দীক্ষা প্রারম্ভিক পর্যায়ে, দীক্ষক (সাধারণত মেথিওনাইন) কোডন রাইবোসোমের ছোট্ট সাবুনিট দ্বারা স্বীকৃত হয়, যার সাথে অ্যামিনোসিয়েটেড মেথিওনিন টিআরএনএ দীক্ষার প্রোটিন উপাদানগুলি ব্যবহার করে সংযুক্ত করা হয়। প্রারম্ভিক কোডনটি স্বীকৃতি দেওয়ার পরে, একটি বৃহত সাবুনিট রাইবোসোমের ছোট্ট সাবুনিটের সাথে যোগ দেয় এবং অনুবাদটির দ্বিতীয় পর্যায়ে প্রসারিত হয় begins এমআরএনএ-এর 5'- থেকে 3'-প্রান্ত পর্যন্ত রাইবোসোমের প্রতিটি পদক্ষেপে, একটি কোডন এর মধ্যে হাইড্রোজেন বন্ধন গঠন করে এবং পরিবহন আরএনএ এর পরিপূরক হয়, যার সাথে সম্পর্কিত এমিনো অ্যাসিডের অবশিষ্টাংশ যুক্ত থাকে। ক্রমবর্ধমান পেপটাইডের সর্বশেষ অ্যামিনো অ্যাসিড অবশিষ্টাংশ এবং টিআরএনএতে সংযুক্ত অ্যামিনো অ্যাসিডের অবশিষ্টাংশের মধ্যে একটি পেপটাইড বন্ধন গঠন রাইবোসোমাল আরএনএ (আরআরএনএ) দ্বারা অনুঘটকিত হয়, যা রাইবোসোমের পেপটিডিল স্থানান্তর কেন্দ্র গঠন করে। এই কেন্দ্রটি নাইট্রোজেন এবং কার্বন পরমাণুকে প্রতিক্রিয়ার উত্তরণের জন্য অনুকূল অবস্থানে রাখে। অনুবাদ তৃতীয় এবং চূড়ান্ত পর্যায়ে, সমাপ্তি ঘটে, যখন রাইবোসোম স্টপ কোডন এ পৌঁছায়, এর পরে প্রোটিন সমাপ্তির কারণগুলি তার শেষ সংশ্লেষ বন্ধ করে শেষ টিআরএনএ এবং পলিপপটিড চেইনের মধ্যে সংযোগ হাইড্রোলাইজ করে। রাইবোসোমে প্রোটিনগুলি সর্বদা N- থেকে সি-টার্মিনাসে সংশ্লেষিত হয়।
নেরিবোসোমাল সংশ্লেষণ
নিম্ন ছত্রাক এবং কিছু ব্যাকটিরিয়ায়, পেপটাইডগুলির জৈব সংশ্লেষণের একটি অতিরিক্ত (নন-রাইবোসোমাল বা মাল্টেনজাইম) পদ্ধতি সাধারণত ছোট এবং অস্বাভাবিক কাঠামো হিসাবে পরিচিত।এই পেপটাইডগুলির সংশ্লেষণ, সাধারণত গৌণ বিপাক, রাইবোসোমের সরাসরি অংশগ্রহণ ছাড়াই একটি উচ্চ আণবিক ওজন প্রোটিন কমপ্লেক্স, এনআরএস সিন্থেস দ্বারা সঞ্চালিত হয়। এনআরএস সিন্থেসে সাধারণত বেশ কয়েকটি ডোমেন বা স্বতন্ত্র প্রোটিন থাকে যা অ্যামিনো অ্যাসিড নির্বাচন করে, পেপটাইড বন্ড গঠন করে এবং সংশ্লেষিত পেপটাইড প্রকাশ করে। একসাথে, এই ডোমেনগুলি মডিউলটি তৈরি করে। প্রতিটি মডিউল সংশ্লেষিত পেপটাইডে একটি এমিনো অ্যাসিড অন্তর্ভুক্তি নিশ্চিত করে। এনআরএস সংশ্লেষগুলি এক বা একাধিক মডিউল দ্বারা গঠিত হতে পারে। কখনও কখনও, এই কমপ্লেক্সগুলিতে একটি এল-এমিনো অ্যাসিড (স্বাভাবিক ফর্ম) কে ডি-ফর্মের মধ্যে আইসোমাইরিজ করতে সক্ষম একটি ডোমেন অন্তর্ভুক্ত থাকে।
রাসায়নিক সংশ্লেষ
জৈব সংশ্লেষণের পদ্ধতিগুলি ব্যবহার করে শর্ট প্রোটিনগুলি রাসায়নিকভাবে সংশ্লেষিত হতে পারে, উদাহরণস্বরূপ, রাসায়নিক লিগেশন। প্রায়শই, পেপটাইডের রাসায়নিক সংশ্লেষণ সি-টার্মিনাস থেকে এন-টার্মিনাসের দিকে ঘটে, রাইবোসোম বায়োসিন্থেসিসের বিপরীতে। রাসায়নিক সংশ্লেষণের পদ্ধতিটি সংক্ষিপ্ত ইমিউনোজেনিক পেপটাইডস (এপিটোপস) উত্পাদন করে যা নির্দিষ্ট অ্যান্টিবডি বা হাইব্রিডোমাস প্রাপ্তির জন্য প্রাণীগুলিতে পরে ইনজেকশনের ব্যবস্থা করা হয়। উপরন্তু, এই পদ্ধতিটি নির্দিষ্ট এনজাইমের ইনহিবিটারগুলি পেতেও ব্যবহৃত হয়। রাসায়নিক সংশ্লেষণটি অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলি প্রবর্তন করতে দেয় যা প্রচলিত প্রোটিনগুলিতে পাওয়া যায় না, উদাহরণস্বরূপ, তাদের পাশের শৃঙ্খলে সংযুক্ত ফ্লুরোসেন্স লেবেলগুলি। প্রোটিন সংশ্লেষণের জন্য রাসায়নিক পদ্ধতির বিভিন্ন সীমাবদ্ধতা রয়েছে: তারা 300 টিরও বেশি অ্যামিনো অ্যাসিডের প্রোটিনের দৈর্ঘ্যের সাথে অকার্যকর, কৃত্রিমভাবে সংশ্লেষিত প্রোটিনগুলির একটি অনিয়মিত তৃতীয় স্তর কাঠামো থাকতে পারে এবং অনুবাদ-পরবর্তী অনুবাদ সংক্রান্ত পরিবর্তনগুলির অভাব থাকতে পারে (নীচে দেখুন)।
অনুবাদ-পরবর্তী পরিবর্তন

অনুবাদ সম্পূর্ণ হওয়ার পরে, বেশিরভাগ প্রোটিন পরবর্তী অনুবাদ-পরবর্তী পরিবর্তনগুলি নামে আরও রাসায়নিক পরিবর্তন করে। প্রোটিনগুলির অনুবাদ-পরবর্তী পরিবর্তনের দুই শতাধিক বৈচিত্র জানা যায়।
অনুবাদ-পরবর্তী পরিবর্তনগুলি কোষের প্রোটিনগুলির জীবনকাল, তাদের এনজাইমেটিক ক্রিয়াকলাপ এবং অন্যান্য প্রোটিনের সাথে মিথস্ক্রিয়া নিয়ন্ত্রণ করতে পারে। কিছু ক্ষেত্রে, অনুবাদ-পরবর্তী পরিবর্তনগুলি প্রোটিন পরিপক্কতার একটি বাধ্যতামূলক পর্যায়, অন্যথায় এটি কার্যত নিষ্ক্রিয়। উদাহরণস্বরূপ, ইনসুলিন এবং কিছু অন্যান্য হরমোনগুলির পরিপক্কতার সাথে, পলিপপটিড চেইনের সীমিত প্রোটোলাইসিস প্রয়োজন, এবং প্লাজমা মেমব্রেন প্রোটিনের পরিপক্কতার সাথে গ্লাইকোসিলেশন প্রয়োজন।
অনুবাদ-পরবর্তী পরিবর্তনগুলি উভয়ই বিস্তৃত এবং বিরল হতে পারে, অনন্য হতে পারে। সর্বজনীন পরিবর্তনের উদাহরণ হ'ল সর্বব্যাপীকরণ (সংক্ষিপ্ত ইউবিকুইটিন প্রোটিনের একাধিক অণুর একটি শৃঙ্খাকে একটি প্রোটিনের সাথে সংযুক্তি), যা প্রোটোসোম দ্বারা এই প্রোটিনের বিভাজনের জন্য সংকেত হিসাবে কাজ করে। আর একটি সাধারণ পরিবর্তন হ'ল গ্লাইকোসিলেশন - এটি অনুমান করা হয় যে মানব প্রোটিনের প্রায় অর্ধেকটি গ্লাইকোসাইলেটেড। দুর্লভ পরিবর্তনের মধ্যে রয়েছে টিউরোসিনেশন / ডিট্রয়েজিনেশন এবং টিউবুলিনের বহুবিচ্ছিন্নকরণ।
এক এবং একই প্রোটিনে অসংখ্য পরিবর্তন হতে পারে। সুতরাং, হিস্টোনস (প্রোটিনগুলি যা ইউকারিয়োটসে ক্রোমাটিনের অংশ) বিভিন্ন অবস্থার অধীনে দেড় শতাধিক বিভিন্ন পরিবর্তন করতে পারে।
অনুবাদ-পরবর্তী পরিবর্তনগুলি এগুলিতে বিভক্ত:
- প্রধান সার্কিট পরিবর্তন,
- এন টার্মিনাল মেথিওনিন অবশিষ্টাংশের বিভাজন,
- সীমিত প্রোটোলাইসিস - প্রোটিনের টুকরো অপসারণ যা প্রান্তগুলি থেকে (সিগন্যাল ক্রমগুলির বিভাজন) থেকে শুরু হতে পারে বা কিছু ক্ষেত্রে অণুর মাঝখানে (ইনসুলিনের পরিপক্কতা),
- অ্যামিনো এবং কার্বক্সাইল গ্রুপগুলিকে মুক্ত করার জন্য বিভিন্ন রাসায়নিক গ্রুপগুলির সংযুক্তি (এন-অ্যাকাইলেশন, মাইরিস্টয়েলেশন ইত্যাদি),
- অ্যামিনো অ্যাসিডের পাশের চেইনের পরিবর্তনগুলি,
- ছোট রাসায়নিক গ্রুপগুলির সংযোজন বা বিভাজন (গ্লাইকোসিলেশন, ফসফোরিলেশন ইত্যাদি),
- লিপিড এবং হাইড্রোকার্বন সংযোজন,
- স্ট্যান্ডার্ড অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলিকে অ-মানক (সিট্রুলাইন গঠন) এ পরিবর্তন করা,
- সিস্টিনের অবশিষ্টাংশের মধ্যে ডিসলফাইড সেতু গঠন,
- ছোট প্রোটিন সংযোজন (Sumoylation এবং সর্বব্যাপী)।
অন্তঃকোষী পরিবহন এবং বাছাই
ইউক্যারিওটিক কোষের সাইটোপ্লাজমে সংশ্লেষিত প্রোটিনগুলি অবশ্যই বিভিন্ন কোষ অর্গানয়েডগুলিতে স্থানান্তরিত করতে হবে: নিউক্লিয়াস, মাইটোকন্ড্রিয়া, এন্ডোপ্লাজমিক রেটিকুলাম (ইপিআর), গোলজি যন্ত্রপাতি, লাইসোসোম ইত্যাদি, এবং কিছু প্রোটিন অবশ্যই বহির্মুখী মাধ্যমের মধ্যে প্রবেশ করতে হবে। কোষের একটি নির্দিষ্ট বিভাগে প্রবেশ করতে, প্রোটিনের একটি নির্দিষ্ট লেবেল থাকতে হবে। বেশিরভাগ ক্ষেত্রে, এই জাতীয় লেবেলটি প্রোটিনের নিজেই অ্যামিনো অ্যাসিডের অনুক্রমের অংশ (লিডার পেপটাইড, বা প্রোটিনের সংকেত ক্রম), তবে কিছু ক্ষেত্রে প্রোটিনের সাথে যুক্ত অলিগোস্যাকারাইডগুলি হ'ল লেবেল।
ইপিআর প্রোটিনের পরিবহন সংশ্লেষিত হওয়ার সাথে সাথেই সঞ্চালিত হয়, যেহেতু ইবিআর এর বাইরের ঝিল্লির বিশেষ প্রোটিনগুলিতে ইপিআর "সিট" এর সিগন্যাল ক্রমযুক্ত প্রোটিন সংশ্লেষ করে রাইবোসোমগুলি। ইপিআর থেকে গোলগি যন্ত্রপাতি পর্যন্ত, এবং সেখান থেকে লিজোসোমগুলি এবং বাহ্যিক ঝিল্লি বা বহির্মুখী মাধ্যম পর্যন্ত, প্রোটিনগুলি ভেসিকুলার পরিবহণের মাধ্যমে প্রবেশ করে। পারমাণবিক স্থানীয়করণ সংকেতযুক্ত প্রোটিনগুলি পারমাণবিক ছিদ্রগুলির মাধ্যমে নিউক্লিয়াসে প্রবেশ করে। মাইটোকন্ড্রিয়া এবং ক্লোরোপ্লাস্টে, প্রোটিনগুলি সম্পর্কিত সংকেত সিকোয়েন্সগুলি বিশিষ্ট প্রোটিন অনুবাদক ছিদ্রগুলির মাধ্যমে চেরোপেরনের অংশগ্রহণে প্রবেশ করে।
কাঠামো এবং অবক্ষয় বজায় রাখা
প্রোটিনগুলির সঠিক স্থানিক কাঠামো বজায় রাখা তাদের সাধারণ ক্রিয়াকলাপের জন্য অত্যন্ত গুরুত্বপূর্ণ। প্রোটিনগুলির ভুল ভাঁজ তাদের একীকরণের দিকে পরিচালিত করে মিউটেশন, জারণ, স্ট্রেস পরিস্থিতি বা কোষের ফিজিওলজিতে বিশ্বব্যাপী পরিবর্তনের কারণে ঘটতে পারে। প্রোটিনের সমষ্টি বয়সের একটি বৈশিষ্ট্যযুক্ত চিহ্ন। এটি বিশ্বাস করা হয় যে অনুযুক্ত প্রোটিন ভাঁজ হ'ল সিস্টিক ফাইব্রোসিস, লাইসোসোমাল জমে থাকা রোগের মতো রোগগুলির কারণ বা বর্ধন ঘটায়। পাশাপাশি নিউরোডিজেনারেটিভ ডিসঅর্ডারস (আলঝাইমারস, হান্টিংটন এবং পার্কিনসনস)।
কোষ বিবর্তনের প্রক্রিয়াতে, চারটি প্রধান প্রক্রিয়া প্রোটিনের সমষ্টিকে মোকাবেলায় তৈরি করা হয়েছে। প্রথম দুটি - পুনরায় ভাঁজ (পুনর্নির্মাণ) চ্যাপেরোনগুলির সাহায্যে এবং প্রোটেসগুলির সাথে বিভাজন - উভয় ব্যাকটিরিয়ায় এবং উচ্চতর প্রাণীর মধ্যে পাওয়া যায়। অটোফ্যাজি এবং বিশেষ অ-ঝিল্লি অর্গানেলসগুলিতে ভুলভাবে ভাঁজ করা প্রোটিনের জমা হওয়া ইউকারিয়োটেসের বৈশিষ্ট্য are

অপসারণের পরে সঠিক ত্রি-মাত্রিক কাঠামো পুনরুদ্ধারে প্রোটিনের ক্ষমতা আমাদের অনুমান করতে দেয় যে প্রোটিনের চূড়ান্ত কাঠামো সম্পর্কে সমস্ত তথ্য তার অ্যামিনো অ্যাসিডের অনুক্রমের মধ্যে রয়েছে। বর্তমানে, যে তত্ত্বটি একটি প্রোটিনের স্থিতিশীল রূপান্তরকে ন্যূনতম মুক্ত শক্তি থাকে তা এই পলিপটিডের অন্যান্য সম্ভাব্য কনফর্মেশনগুলির সাথে তুলনা করা হয়।
কোষে প্রোটিনের একটি গ্রুপ রয়েছে যার কাজটি হ'ল রাইবোসোমে সংশ্লেষণের পরে অন্যান্য প্রোটিনের সঠিক ভাঁজ নিশ্চিত করা, তাদের ক্ষতির পরে প্রোটিনের কাঠামো পুনরুদ্ধার করতে, পাশাপাশি প্রোটিন কমপ্লেক্সগুলি তৈরি এবং বিচ্ছিন্নকরণ। এই প্রোটিনগুলিকে চ্যাপেরোন বলা হয়। ঘরের অনেক চ্যাপেরোনগুলির ঘনত্ব ঘনীভূত তাপমাত্রার তীব্র বৃদ্ধির সাথে বৃদ্ধি পায়, সুতরাং তারা এইচএসপি গ্রুপের অন্তর্ভুক্ত (ইংলিশ হিট শক প্রোটিন - হিট শক প্রোটিন)। শরীরের ক্রিয়াকলাপের জন্য চ্যাপেরোনগুলির স্বাভাবিক ক্রিয়াকলাপের গুরুত্ব α-ক্রিস্টালিন চ্যাপেরোন উদাহরণ দিয়ে ব্যাখ্যা করা যেতে পারে, যা মানুষের চোখের লেন্সের অংশ। এই প্রোটিনের মিউটেশনগুলি প্রোটিনের একত্রিত হওয়ার কারণে লেন্সের মেঘলা বাড়ে এবং ফলস্বরূপ, ছানি হয়ে যায়।
যদি প্রোটিনগুলির তৃতীয় স্তর পুনরুদ্ধার করা না যায় তবে সেগুলি সেলে ধ্বংস হয়। প্রোটিনকে হ্রাস করে এমন এনজাইমগুলিকে প্রোটেস বলা হয়।স্তর অণুর আক্রমণ করার জায়গায়, প্রোটোলিটিক এনজাইমগুলি এন্ডোপটিডেস এবং এক্সোপটিডেসে বিভক্ত হয়:
- এন্ডোপটিডেসস বা প্রোটিনেসেস পেপটাইড শৃঙ্খলে থাকা পেপটাইড বন্ধনগুলি। তারা স্তরগুলির সংক্ষিপ্ত পেপটাইড ক্রমগুলি সনাক্ত করে এবং আবদ্ধ করে এবং কিছু অ্যামিনো অ্যাসিডের অবশিষ্টাংশের মধ্যে বন্ধনগুলিকে তুলনামূলকভাবে হাইড্রোলাইজ করে।
- এক্সপেপটিডেসস চেইনের প্রান্ত থেকে হাইড্রোলাইজ পেপটাইডস: এন-টার্মিনাস থেকে অ্যামিনোপটিডেসস, সি-টার্মিনাস থেকে কারবক্সেপটিডেসগুলি। অবশেষে, ডিপপটিডেসস ক্লিভ কেবল ডিপপিডাইডস।
ক্যাটালাইসিস মেকানিজম অনুসারে, ইন্টারন্যাশনাল ইউনিয়ন ফর বায়োকেমিস্ট্রি এবং মলিকুলার বায়োলজি সিরিয়ান প্রোটেস, অ্যাস্পার্টিক প্রোটেস, সিস্ট সিস্টাইন প্রোটেস এবং মেটালোপ্রোটেসিস সহ বেশ কয়েকটি শ্রেণীর প্রোটেস চিহ্নিত করে।
ইউক্রিয়োটেস, আর্চিয়া এবং কিছু ব্যাকটেরিয়ার নিউক্লিয়াস এবং সাইটোপ্লাজমে উপস্থিত এক প্রকার প্রোটাস হ'ল প্রোটাইসোম।
লক্ষ্যযুক্ত প্রোটিনটি প্রোটোসোম দ্বারা ক্লিভ করার জন্য, এটির সাথে একটি ছোট ইউবুইকিটিন প্রোটিন সংযুক্ত করে এটির লেবেল লাগাতে হবে। ইউবুইকিটিন সংযোজন বিক্রিয়া ইউজিকুইটিন লিগ্যাসেস এনজাইম দ্বারা অনুঘটকিত হয়। প্রোটিনে প্রথম ইউবুইকিটিন অণু যুক্ত ইউবিকুইটিন অণুগুলির আরও সংযোজনের জন্য লিগ্যাসগুলির সংকেত হিসাবে কাজ করে। ফলস্বরূপ, একটি পলিউবিকিউটিন চেইন প্রোটিনের সাথে সংযুক্ত থাকে, যা প্রোটাসোমের সাথে আবদ্ধ হয় এবং লক্ষ্য প্রোটিনের বিভাজন নিশ্চিত করে। সাধারণভাবে, এই ব্যবস্থাকে ইউবুইকিটিন-নির্ভর প্রোটিন অবক্ষয় বলা হয়। আন্তঃকোষীয় প্রোটিনের ৮০-৯০% অবক্ষয় প্রোটাসোমের অংশগ্রহনের সাথে ঘটে।
পেরোক্সিসোমে প্রোটিনের অবক্ষয় কোষ চক্র, জিনের প্রকাশের নিয়ন্ত্রণ এবং অক্সিডেটিভ স্ট্রেসের প্রতিক্রিয়া সহ অনেক সেলুলার প্রক্রিয়াগুলির জন্য গুরুত্বপূর্ণ।

অটোফ্যাজি হ'ল দীর্ঘকালীন জীবিত বায়োমোলিকুলের, বিশেষত প্রোটিনে, পাশাপাশি লাইসোসোমে (স্তন্যপায়ী প্রাণীদের মধ্যে) বা ভ্যাকুওলে (খামির মধ্যে) অর্গানেলস অবক্ষয়ের প্রক্রিয়া। অটোফোগি কোনও সাধারণ কোষের গুরুত্বপূর্ণ ক্রিয়াকলাপের সাথে থাকে তবে পুষ্টির অভাব, সাইটোপ্লাজমে ক্ষতিগ্রস্থ অর্গানেলগুলির উপস্থিতি এবং অবশেষে, সাইটোপ্লাজমে আংশিকভাবে হ্রাসপ্রাপ্ত প্রোটিনগুলির উপস্থিতি এবং তাদের সমষ্টি কোষগুলিতে অটোফ্যাজির প্রক্রিয়া বৃদ্ধির জন্য উদ্দীপনা হিসাবে কাজ করতে পারে।
তিন ধরণের অটোফ্যাজি পৃথক করা হয়: মাইক্রোঅটোফ্যাগি, ম্যাক্রোআউটোফ্যাগি এবং চ্যাপেরোন নির্ভর নির্ভর অটোফি।
মাইক্রোআউটোফ্যাগির সময়, ম্যাক্রোমোলিকুলস এবং কোষের ঝিল্লির টুকরো লিজোসোমে ধরা পড়ে। এইভাবে, কোষ শক্তি বা বিল্ডিং উপাদানের অভাব সহ প্রোটিন হজম করতে পারে (উদাহরণস্বরূপ, অনাহারে)। তবে মাইক্রোআউটোফ্যাগির প্রক্রিয়াগুলি সাধারণ পরিস্থিতিতে ঘটে এবং সাধারণত নির্বিচারে হয়। কখনও কখনও মাইক্রোঅটোফ্যাগির সময় অরগানয়েডগুলিও হজম হয়, উদাহরণস্বরূপ, পেরোক্সিসোমগুলির মাইক্রোঅটোফ্যাগি এবং নিউক্লিয়ায় আংশিক মাইক্রোঅটোফ্যাগি যেখানে কোষটি व्यवहार्य থাকে সেগুলি খামির হিসাবে বর্ণনা করা হয়।
ম্যাক্রোঅ্যাটোফ্যাগিতে, সাইটোপ্লাজমের একটি অংশ (প্রায়শই কোনও অর্গানয়েড থাকে) এন্ডোপ্লাজমিক রেটিকুলামের একটি জলাশয়ের মতো একটি ঝিল্লি বগি দ্বারা বেষ্টিত থাকে। ফলস্বরূপ, এই সাইটটি দুটি মেমব্রেন দ্বারা বাকী সাইটোপ্লাজমের থেকে পৃথক করা হয়েছে। এই জাতীয় ডাবল ঝিল্লি অর্গানেলসকে অটোফাগোসোমস বলা হয়। অটোফাগোসোমগুলি লাইসোসোমের সাথে মিশে যায়, অটোফাগোলিসোসোমগুলি তৈরি করে, যার মধ্যে অর্গানেলস এবং অটোফাগোসোমগুলির বাকী বিষয়বস্তু হজম হয়। স্পষ্টতই, ম্যাক্রোঅটোফ্যাগিটিও অ-নির্বাচনমূলক, যদিও এটি প্রায়শই জোর দেওয়া হয় যে এর সাহায্যে কোষটি "পুরানো" (মাইটোকন্ড্রিয়া, রাইবোসোম ইত্যাদি) অর্গানয়েডগুলি থেকে মুক্তি পেতে পারে।
তৃতীয় ধরণের অটোফাজি হ'ল চ্যাপেরোন নির্ভর। এই পদ্ধতিতে সাইটোপ্লাজম থেকে লাইসোসোম ঝিল্লির মধ্য দিয়ে তার গহ্বরে আংশিক অস্বচ্ছৃত প্রোটিনের পরিবহন পরিচালিত হয়, যেখানে তারা হজম হয়। কেবলমাত্র স্তন্যপায়ী প্রাণীদের মধ্যে বর্ণিত এই ধরণের অটোফ্যাজি চাপ দ্বারা উত্সাহিত হয়।

JUNQ এবং আইপড
মানসিক চাপের মধ্যে, যখন কোনও ইউক্যারিওটিক সেল প্রচুর পরিমাণে হ্রাসপ্রাপ্ত প্রোটিনের সংক্রমণ মোকাবেলা করতে না পারে, তখন তারা দুটি ধরণের অস্থায়ী অর্গানেলগুলির মধ্যে একটিতে পাঠানো যেতে পারে - জুনকিউ এবং আইপিড (ইংরেজি) রাশিয়ান। ।
জুনকিউ (ইঞ্জিনিয়ার জক্স্তা নিউক্লিয়ার কোয়ালিটি কন্ট্রোল কম্পার্টমেন্ট) পারমাণবিক ঝিল্লির বাইরের দিকের সাথে সম্পর্কিত এবং এতে সর্বব্যাপী প্রোটিন রয়েছে যা দ্রুত সাইটোপ্লাজমে স্থানান্তর করতে পারে, পাশাপাশি চ্যাপেরোনস এবং প্রোটোসোমগুলিও রয়েছে। JUNQ এর উদ্দেশ্যযুক্ত ফাংশন হ'ল প্রোটিনগুলি পুনরায় বিক্রি করা এবং হ্রাস করা।
আইপিড (ইংলিশ ইনসোলিউবল প্রোটিন ডিপোজিট - অদ্রবণীয় প্রোটিন জমা করার স্থান) কেন্দ্রীয় ভ্যাকোওলের নিকটে অবস্থিত এবং এতে অ্যামাইলয়েড-গঠনকারী প্রোটিনের স্থিতিশীল সমষ্টি রয়েছে। আইপিডে এই প্রোটিনগুলির জমাগুলি সাধারণ সেলুলার স্ট্রাকচারগুলির সাথে তাদের মিথস্ক্রিয়াকে আটকাতে পারে, সুতরাং এটি বিশ্বাস করা হয় যে এই অন্তর্ভুক্তির একটি প্রতিরক্ষামূলক কার্য রয়েছে।
দেহে প্রোটিনের ক্রিয়া
অন্যান্য জৈবিক ম্যাক্রোমোলিকুলস (পলিস্যাকারাইডস, লিপিডস এবং নিউক্লিক এসিড) এর মতো প্রোটিনও সমস্ত জীবের প্রয়োজনীয় উপাদান এবং কোষের জীবনে গুরুত্বপূর্ণ ভূমিকা পালন করে। প্রোটিন বিপাক প্রক্রিয়া চালায়। এগুলি আন্তঃকোষীয় কাঠামোর অংশ - অরগানেলস এবং সাইটোস্কেলটন, বহির্মুখী স্থানের মধ্যে লুকানো, যেখানে তারা কোষের মধ্যে সংক্রমণিত সংকেত হিসাবে কাজ করতে পারে, খাদ্যের জলবিদ্যুতে এবং আন্তঃকোষীয় পদার্থ গঠনে অংশ নিতে পারে।
প্রোটিনগুলি তাদের ফাংশন অনুযায়ী শ্রেণীবদ্ধকরণ বরং স্বেচ্ছাচারী, যেহেতু একই প্রোটিন বেশ কয়েকটি কার্য সম্পাদন করতে পারে। এ জাতীয় বহিরাগততার একটি সু-অধ্যয়নিত উদাহরণ হ'ল লাইসাইল টিআরএনএ সিন্থেটেজ, এমিনোসিল টিআরএনএ সিন্থেটেসেসের শ্রেণীর একটি এনজাইম, যা কেবল লাইসিনের অবশিষ্টাংশকে টিআরএনএ-তে সংযুক্ত করে না, তবে বেশ কয়েকটি জিনের প্রতিলিপিও নিয়ন্ত্রণ করে। প্রোটিনগুলি তাদের এনজাইমেটিক ক্রিয়াকলাপের কারণে অনেকগুলি কার্য সম্পাদন করে। সুতরাং, এনজাইমগুলি হ'ল মায়োসিন মোটর প্রোটিন, নিয়ন্ত্রক প্রোটিন কিনেজ প্রোটিন, পরিবহন প্রোটিন সোডিয়াম-পটাসিয়াম অ্যাডেনোসিন ট্রাইফোসফেটেস ইত্যাদি are

অনুঘটক ফাংশন
দেহের প্রোটিনগুলির সর্বাধিক পরিচিত কাজ হ'ল বিভিন্ন রাসায়নিক প্রতিক্রিয়ার অনুঘটক। এনজাইমগুলি এমন প্রোটিন যাগুলির নির্দিষ্ট অনুঘটক বৈশিষ্ট্য রয়েছে, অর্থাৎ প্রতিটি এনজাইম এক বা একাধিক অনুরূপ প্রতিক্রিয়া অনুঘটক করে। এনজাইমগুলি ডিএনএর প্রতিরূপ এবং মেরামত এবং ম্যাট্রিক্স আরএনএ সংশ্লেষ সহ জটিল অণুগুলির (বিভাজন) এবং তাদের সংশ্লেষণের (অ্যানাবোলিজম) বিভাজনকে অনুঘটক করে। ২০১৩ সালের মধ্যে ৫ হাজারেরও বেশি এনজাইম বর্ণনা করা হয়েছে। এনজাইমেটিক ক্যাটালাইসিসের ফলস্বরূপ বিক্রিয়াটির ত্বরণটি প্রচুর পরিমাণে হতে পারে: এনজাইম অরোটিডিন-5'-ফসফেট ডিকারবক্সিলাস দ্বারা অনুঘটকিত প্রতিক্রিয়া, উদাহরণস্বরূপ, অ-অনুঘটক একের চেয়ে 10 গুণ গতিতে এগিয়ে যায় (এনজাইম ছাড়া অরোটিক অ্যাসিডের ডিকারোবক্সিয়েশনের অর্ধজীবন) এবং এনজাইম সংঘটিত 18 মিল অন্তর্ভুক্ত থাকে। অণুগুলি যা এনজাইমের সাথে সংযুক্ত থাকে এবং প্রতিক্রিয়ার ফলে পরিবর্তিত হয় তাকে স্তর বলে subst
যদিও এনজাইমগুলি প্রায়শই শত শত অ্যামিনো অ্যাসিডের অবশিষ্টাংশ সমন্বয়ে গঠিত হয়, তবে তাদের মধ্যে কেবলমাত্র একটি সামান্য ভগ্নাংশ সাবস্ট্রেটের সাথে যোগাযোগ করে এবং এমনকি আরও কম পরিমাণে - গড়ে প্রায় 3-4 টি অ্যামিনো অ্যাসিডের অবশিষ্টাংশ, প্রায়শই প্রাথমিক কাঠামোর একে অপরের থেকে দূরে অবস্থিত - সরাসরি অনুঘটকটিতে জড়িত। এনজাইম অণুর যে অংশটি স্তর এবং ক্যাটালাইসিসের বাঁধাই সরবরাহ করে তাকে সক্রিয় কেন্দ্র বলা হয়।
1992 সালে, আন্তর্জাতিক জৈব রসায়ন এবং অণুবিজ্ঞান ইউনিয়ন তাদের দ্বারা অনুঘটকিত প্রতিক্রিয়ার ধরণের ভিত্তিতে এনজাইমগুলির শ্রেণিবদ্ধ নামকরণের চূড়ান্ত সংস্করণ প্রস্তাব করেছিল proposed এই নামকরণ অনুসারে এনজাইমের নামগুলি সর্বদা শেষ হতে হবে -বেসিক এবং অনুঘটক প্রতিক্রিয়াগুলির নাম এবং তাদের স্তরগুলি থেকে গঠন করে। প্রতিটি এনজাইমকে একটি পৃথক কোড অর্পণ করা হয় যার দ্বারা এনজাইমগুলির শ্রেণিবিন্যাসের অবস্থান নির্ধারণ করা সহজ।অনুঘটকিত বিক্রিয়াগুলির ধরণ অনুসারে, সমস্ত এনজাইমগুলি 6 শ্রেণিতে বিভক্ত:
- সিএফ 1: অক্সিডোরগুলি অপডাকশনগুলি যা রেডক্স প্রতিক্রিয়ার অনুঘটক করে,
- সিএফ 2: এমন একটি স্থানান্তর ঘটে যা রাসায়নিক গ্রুপগুলির এক স্তর থেকে অন্য অণু থেকে অন্য স্তরে স্থানান্তরকে অনুঘটক করে,
- সিএফ 3: হাইড্রোলেসেস রাসায়নিক বন্ধনের জলবিদ্যুত অনুঘটক করে,
- সিএফ 4: লায়াস হাইড্রোলাইসিস ছাড়াই রাসায়নিক বন্ধনগুলির বিরতি অনুঘটক করে পণ্যগুলির মধ্যে একটিতে ডাবল বন্ড গঠন করে,
- সিএফ 5: আইসোমেরেসগুলি স্তর অণুতে কাঠামোগত বা জ্যামিতিক পরিবর্তনগুলি অনুঘটক করে তোলে,
- সিএফ:: লিগ্যাসেসগুলি যা এটিপি ডিফোসফেট বন্ডের বা হাইড্রোলাইসিস বা এই জাতীয় ট্রাইফসফেটের হাইড্রোলাইসিসের কারণে স্তরগুলির মধ্যে রাসায়নিক বন্ধন গঠনের অনুঘটক করে।
কাঠামোগত ফাংশন
সাইটোস্কেলিটনের স্ট্রাকচারাল প্রোটিনগুলি এক ধরণের আর্ম্যাচার, শেপ সেল এবং অনেক অর্গানয়েড হিসাবে এবং কোষগুলির আকৃতি পরিবর্তনে জড়িত। বেশিরভাগ স্ট্রাকচারাল প্রোটিনগুলি ফিলাম্যান্টাস হয়: অ্যাক্টিন এবং টিউবুলিন মনোমারগুলি উদাহরণস্বরূপ, গ্লোবুলার, দ্রবণীয় প্রোটিন হয় তবে পলিমারাইজেশন পরে তারা দীর্ঘ স্ট্রড গঠন করে যা সাইটোস্কেলটন তৈরি করে, যা কোষকে আকৃতি বজায় রাখার অনুমতি দেয়। কোলাজেন এবং ইলাস্টিন সংযোগকারী টিস্যুর আন্তঃকোষীয় পদার্থের প্রধান উপাদান (উদাহরণস্বরূপ, কার্টিলেজ) এবং চুল, নখ, পাখির পালক এবং কিছু শাঁস অন্য কের্যাটিন স্ট্রাকচারাল প্রোটিন দ্বারা গঠিত।

প্রতিরক্ষামূলক কাজ
প্রোটিনের বিভিন্ন ধরণের সুরক্ষামূলক কার্যাদি রয়েছে:
- শারীরিক সুরক্ষা। শরীরের শারীরিক সুরক্ষা কোলাজেন দ্বারা সরবরাহ করা হয়, একটি প্রোটিন যা সংযোগকারী টিস্যুগুলির অন্তঃকোষীয় পদার্থের ভিত্তি তৈরি করে (হাড়, কারটিলেজ, টেন্ডস এবং ত্বকের গভীর স্তর (ডার্মিস)), কেরাটিন, যা শৃঙ্গাকার shাল, চুল, পালক, শিং এবং এপিডার্মিসের অন্যান্য ডেরাইভেটিভগুলির ভিত্তি তৈরি করে। সাধারণত, এই জাতীয় প্রোটিনগুলি স্ট্রাকচারাল ফাংশন সহ প্রোটিন হিসাবে বিবেচিত হয়। এই গ্রুপের প্রোটিনগুলির উদাহরণগুলি হ'ল ফাইব্রিনোজেন এবং রক্ত জমাট বাঁধার জন্য জড়িত থ্রোমবিন।
- রাসায়নিক সুরক্ষা। প্রোটিন অণুতে টক্সিনের বাঁধাই তাদের ডিটক্সিফিকেশন সরবরাহ করতে পারে। মানুষের ডিটক্সিফিকেশনে বিশেষত গুরুত্বপূর্ণ ভূমিকাটি লিভারের এনজাইমগুলির দ্বারা পরিচালিত হয় যা বিষগুলি ভেঙে দেয় বা দ্রবণীয় আকারে রূপান্তর করে, যা শরীর থেকে তাদের দ্রুত নির্মূলকরণে অবদান রাখে।
- প্রতিরোধ প্রতিরক্ষা। রক্ত এবং শরীরের অন্যান্য তরল তৈরি করে এমন প্রোটিনগুলি রোগজীবাণুগুলির ক্ষতি এবং আক্রমণ উভয়ের জন্য শরীরের প্রতিরক্ষামূলক প্রতিক্রিয়াতে জড়িত। পরিপূরক সিস্টেম এবং অ্যান্টিবডিগুলির প্রোটিনগুলি (ইমিউনোগ্লোবুলিন) দ্বিতীয় গ্রুপের প্রোটিনের সাথে সম্পর্কিত, তারা ব্যাকটিরিয়া, ভাইরাস বা বিদেশী প্রোটিনকে নিরপেক্ষ করে। অ্যান্টিবডিগুলি যেগুলি অভিযোজক প্রতিরোধ ব্যবস্থাটির অংশ, তারা দেহের বাইরে বিদেশী পদার্থের সাথে সংযুক্ত থাকে, অ্যান্টিজেনগুলি এবং এর ফলে এগুলি নিরপেক্ষ করে, ধ্বংসের জায়গায় নিয়ে যায়। অ্যান্টিবডিগুলি আন্তঃকোষীয় স্থানে লুকিয়ে বা বিশেষায়িত বি-লিম্ফোসাইটের ঝিল্লিতে স্থির করা যায় যা প্লাজমোসাইট বলে tes
নিয়ন্ত্রক কাজ
কোষের অভ্যন্তরে অনেকগুলি প্রক্রিয়া প্রোটিন অণু দ্বারা নিয়ন্ত্রিত হয়, যা না শক্তির উত্স, না কোষের জন্য কোনও বিল্ডিং উপাদান। এই প্রোটিনগুলি কোষ চক্র, প্রতিলিপি, অনুবাদ, স্প্লিক্লিং, অন্যান্য প্রোটিনের ক্রিয়াকলাপ এবং অন্যান্য অনেক প্রক্রিয়াতে কোষের অগ্রগতি নিয়ন্ত্রণ করে। প্রোটিনগুলি এনজাইমেটিক ক্রিয়াকলাপের কারণে (উদাহরণস্বরূপ, প্রোটিন কিনেস), বা অন্যান্য অণুগুলিতে নির্দিষ্ট বাঁধার কারণে নিয়ন্ত্রক কার্য সম্পাদন করে। সুতরাং, ট্রান্সক্রিপশন কারণ, অ্যাক্টিভেটর প্রোটিন এবং রিপ্রেসার প্রোটিনগুলি তাদের নিয়ন্ত্রক অনুক্রমের সাথে আবদ্ধ হয়ে জিনের প্রতিলিপি তীব্রতা নিয়ন্ত্রণ করতে পারে। অনুবাদ পর্যায়ে, অনেক এমআরএনএ পড়ার বিষয়টিও প্রোটিনের উপাদানগুলির সংযোজন দ্বারা নিয়ন্ত্রিত হয়।
আন্তঃকোষীয় প্রক্রিয়াগুলির নিয়ন্ত্রণের ক্ষেত্রে সবচেয়ে গুরুত্বপূর্ণ ভূমিকাটি প্রোটিন কিনেস এবং প্রোটিন ফসফেটেসস দ্বারা চালিত হয় - এনজাইমগুলি অন্য প্রোটিনগুলির সাথে তাদের সংযুক্তি বা ফসফেট গ্রুপগুলিকে বিভক্ত করে বা সক্রিয় করে বাধা দেয়।

সিগন্যাল ফাংশন
প্রোটিনের সিগন্যাল ফাংশন হ'ল কোষ, টিস্যু, অঙ্গ এবং প্রাণীর মধ্যে সংকেত সংক্রমণকারী সংকেত পদার্থ হিসাবে প্রোটিনের পরিবেশন করার ক্ষমতা। প্রায়শই, সংকেত ফাংশনটি নিয়ন্ত্রকের সাথে মিলিত হয়, যেহেতু অনেকগুলি আন্তঃকোষীয় নিয়ামক প্রোটিন সংকেতও প্রেরণ করে।
সংকেত ফাংশন হরমোন প্রোটিন, সাইটোকাইনস, বৃদ্ধির কারণগুলি ইত্যাদি দ্বারা সঞ্চালিত হয়
হরমোনগুলি রক্ত দ্বারা বাহিত হয়। বেশিরভাগ প্রাণীর হরমোন হ'ল প্রোটিন বা পেপটাইড। তার রিসেপ্টরের কাছে হরমোনের বাঁধাই এমন একটি সংকেত যা কোনও কোষের প্রতিক্রিয়া শুরু করে। হরমোনগুলি রক্ত এবং কোষে পদার্থের ঘনত্ব, বৃদ্ধি, প্রজনন এবং অন্যান্য প্রক্রিয়াগুলিকে নিয়ন্ত্রণ করে। এই জাতীয় প্রোটিনগুলির একটি উদাহরণ হ'ল ইনসুলিন, যা রক্তে গ্লুকোজের ঘনত্বকে নিয়ন্ত্রণ করে।
কোষগুলি আন্তঃকোষীয় পদার্থের মাধ্যমে সংক্রমণিত সংকেত প্রোটিনগুলি ব্যবহার করে একে অপরের সাথে যোগাযোগ করে। এই জাতীয় প্রোটিনগুলির মধ্যে রয়েছে উদাহরণস্বরূপ, সাইটোকাইনস এবং বৃদ্ধির কারণগুলি।
সাইটোকাইনস পেপটাইড সংকেত অণু হয়। তারা কোষগুলির মধ্যে মিথস্ক্রিয়া নিয়ন্ত্রণ করে, তাদের বেঁচে থাকা নির্ধারণ করে, বৃদ্ধি, পার্থক্য, কার্যকরী ক্রিয়াকলাপ এবং অ্যাপোপটোসিসকে উদ্দীপিত বা প্রতিরোধ করে, প্রতিরোধ ক্ষমতা, অন্তঃস্রাব এবং স্নায়ুতন্ত্রের সমন্বয় নিশ্চিত করে। সাইটোকাইনের একটি উদাহরণ টিউমার নেক্রোসিস ফ্যাক্টর, যা দেহের কোষগুলির মধ্যে প্রদাহজনক সংকেত সঞ্চার করে।
অতিরিক্ত (স্ট্যান্ডবাই) ফাংশন
এই জাতীয় প্রোটিনগুলির মধ্যে তথাকথিত রিজার্ভ প্রোটিন অন্তর্ভুক্ত থাকে, যা উদ্ভিদের বীজে শক্তি এবং পদার্থের উত্স হিসাবে সংরক্ষণ করা হয় (উদাহরণস্বরূপ, 7 এস এবং 11 এস গ্লোবুলিন) এবং প্রাণীর ডিম। অ্যামিনো অ্যাসিডের উত্স হিসাবে শরীরে প্রচুর অন্যান্য প্রোটিন ব্যবহার করা হয় যা জৈবিকভাবে সক্রিয় পদার্থগুলির পূর্ববর্তী যা বিপাকীয় প্রক্রিয়াগুলিকে নিয়ন্ত্রণ করে।

রিসেপটর ফাংশন
প্রোটিন রিসেপ্টরগুলি উভয় সাইটোপ্লাজমে অবস্থিত হতে পারে এবং কোষের ঝিল্লিতে সংহত হতে পারে। রিসেপ্টর অণুর একটি অংশ একটি সংকেত গ্রহণ করে, যা প্রায়শই কোনও রাসায়নিক পদার্থ দ্বারা পরিবেশন করা হয়, এবং কিছু ক্ষেত্রে - হালকা, যান্ত্রিক চাপ (উদাহরণস্বরূপ, প্রসারিত) এবং অন্যান্য উদ্দীপনা। যখন সংকেত অণুর একটি নির্দিষ্ট অংশের সংস্পর্শে আসে - রিসেপ্টর প্রোটিন - এর গঠনগত পরিবর্তন ঘটে। ফলস্বরূপ, অণুর আরও একটি অংশের রূপান্তর, যা অন্যান্য সেলুলার উপাদানগুলিতে সংকেত স্থানান্তর করে, পরিবর্তিত হয়। বেশ কয়েকটি সংকেত সংক্রমণ প্রক্রিয়া রয়েছে mechan কিছু রিসেপ্টর একটি নির্দিষ্ট রাসায়নিক প্রতিক্রিয়া অনুঘটক করে, অন্যরা আয়ন চ্যানেল হিসাবে পরিবেশন করে, যা সংকেতের ক্রিয়াটি খোলে বা বন্ধ হয়, অন্যরা বিশেষত আন্তঃকোষীয় মধ্যস্থতার রেণুগুলিকে আবদ্ধ করে। ঝিল্লি রিসেপ্টরগুলিতে, সংকেত অণুতে আবদ্ধ অণুর অংশটি কোষের পৃষ্ঠে থাকে এবং যে ডোমেনটি সংকেত সংক্রমণ করে তা ভিতরে থাকে।
মোটর (মোটর) ফাংশন
মোটর প্রোটিনগুলির একটি সম্পূর্ণ শ্রেণীর শরীরের গতিবিধি সরবরাহ করে, উদাহরণস্বরূপ, পেশী সংকোচনের সাথে সাথে লোকোমোশন (মায়োসিন), শরীরের অভ্যন্তরে কোষের চলাচল (উদাহরণস্বরূপ, লিউকোসাইটের অ্যামিবোড আন্দোলন), সিলিয়া এবং ফ্ল্যাজেলার আন্দোলন, পাশাপাশি সক্রিয় এবং নির্দেশিত আন্তঃকোষীয় পরিবহন (কেইনসিন, ডাইনেইন) সরবরাহ করে । ডাইনেইনস এবং কেইনসিনগুলি শক্তির উত্স হিসাবে এটিপি হাইড্রোলাইসিস ব্যবহার করে মাইক্রোটুবুলগুলির সাথে অণু পরিবহন করে। ডাইনেইনস কোষের পেরিফেরাল অংশগুলি থেকে সেন্ট্রোসোম, কিনসিনগুলিতে অণু এবং অর্গানেলগুলি স্থানান্তর করে - বিপরীত দিকে in ডাইনেইনস ইউক্যারিওটিসের সিলিয়া এবং ফ্ল্যাজেলার আন্দোলনের জন্যও দায়ী। মায়োসিনের সাইটোপ্লাজমিক রূপগুলি মাইক্রোফিলামেন্টগুলির মাধ্যমে অণু এবং অর্গানয়েডগুলির পরিবহনে জড়িত হতে পারে।
বিপাক প্রোটিন
বেশিরভাগ অণুজীব এবং উদ্ভিদগুলি 20 স্ট্যান্ডার্ড অ্যামিনো অ্যাসিডগুলির পাশাপাশি সিট্রুলাইন হিসাবে অতিরিক্ত (অ-মানক) অ্যামিনো অ্যাসিড সংশ্লেষ করতে পারে।তবে যদি পরিবেশে অ্যামিনো অ্যাসিডের অস্তিত্ব থাকে, এমনকি অণুজীবগুলিও অ্যামিনো অ্যাসিডগুলি কোষগুলিতে পরিবহণ করে এবং তাদের জৈবিক সিন্থেটিক পাথ বন্ধ করে শক্তি সংরক্ষণ করে।
অ্যামিনো অ্যাসিড যা প্রাণীদের দ্বারা সংশ্লেষিত হতে পারে না তাদের প্রয়োজনীয় বলা হয়। বায়োসিন্থেটিক পাথপথের প্রধান এনজাইমগুলি উদাহরণস্বরূপ, এস্পারেট কিনেস, যা এস্পার্টেট থেকে লাইসিন, মেথিয়নিন এবং থ্রোনিন গঠনের প্রথম ধাপটি অনুঘটক করে, তারা প্রাণীদের মধ্যে অনুপস্থিত।
প্রাণীরা মূলত খাবারে পাওয়া প্রোটিন থেকে অ্যামিনো অ্যাসিড পান। হজমের সময় প্রোটিনগুলি নষ্ট হয়ে যায়, যা সাধারণত প্রোটিনকে অ্যাসিডিক পরিবেশে রাখার মাধ্যমে এবং প্রোটেস নামক এনজাইম ব্যবহার করে হাইড্রোলাইজিংয়ের মাধ্যমে শুরু হয় with হজমের ফলস্বরূপ প্রাপ্ত কিছু অ্যামিনো অ্যাসিডগুলি শরীরের প্রোটিনগুলির সংশ্লেষণের জন্য ব্যবহৃত হয়, বাকি অংশগুলি গ্লুকোনোজেনেসিসের সময় গ্লুকোজে রূপান্তরিত হয় বা ক্রেবস চক্রে ব্যবহৃত হয়। শক্তির উত্স হিসাবে প্রোটিনের ব্যবহার বিশেষত রোজার পরিস্থিতিতে গুরুত্বপূর্ণ, যখন দেহের নিজস্ব প্রোটিন, বিশেষত পেশীগুলি শক্তির উত্স হিসাবে পরিবেশন করে। অ্যামিনো অ্যাসিডও শরীরের পুষ্টিতে নাইট্রোজেনের একটি গুরুত্বপূর্ণ উত্স।
মানব প্রোটিন গ্রহণের জন্য কোনও ইউনিফাইড মান নেই। বৃহত অন্ত্রের মাইক্রোফ্লোরা অ্যামিনো অ্যাসিড সংশ্লেষ করে যা প্রোটিনের নিয়ম প্রস্তুতের ক্ষেত্রে বিবেচনায় নেওয়া হয় না।
অধ্যয়ন পদ্ধতি
প্রোটিনগুলির গঠন এবং কার্যগুলি উভয় বিশুদ্ধ প্রস্তুতির উপর অধ্যয়ন করা হয় ইন ভিট্রো, এবং জীবিত জীবের মধ্যে তাদের প্রাকৃতিক পরিবেশে, ভিভোতে। নিয়ন্ত্রিত অবস্থার অধীনে খাঁটি প্রোটিনগুলির অধ্যয়নগুলি তাদের কার্যকারিতা নির্ধারণের জন্য দরকারী: এনজাইমের অনুঘটক কার্যকলাপের গতিগত বৈশিষ্ট্য, বিভিন্ন স্তরগুলির সাথে আপেক্ষিক স্নেহ ইত্যাদি প্রোটিন অধ্যয়ন ভিভোতে কোষে বা পুরো জীবগুলিতে তারা কোথায় কাজ করে এবং কীভাবে তাদের কার্যকলাপ নিয়ন্ত্রণ করা হয় সে সম্পর্কে অতিরিক্ত তথ্য সরবরাহ করে।
আণবিক এবং সেলুলার জীববিজ্ঞান

আণবিক এবং সেলুলার বায়োলজি পদ্ধতিগুলি সাধারণত কোনও কোষে প্রোটিনগুলির সংশ্লেষণ এবং স্থানীয়করণ অধ্যয়ন করতে ব্যবহৃত হয়। স্থানীয়করণ অধ্যয়নের একটি পদ্ধতি ব্যাপকভাবে ব্যবহৃত হয়, একটি কোষে চিমেরিক প্রোটিনের সংশ্লেষণের উপর ভিত্তি করে, অধ্যয়ন প্রোটিনের সমন্বয়ে, "রিপোর্টার" এর সাথে সংযুক্ত, উদাহরণস্বরূপ, সবুজ ফ্লুরোসেন্ট প্রোটিন (জিএফপি)। কোষে এই জাতীয় প্রোটিনের অবস্থানটি প্রতিপ্রভ মাইক্রোস্কোপ ব্যবহার করে দেখা যায়। এছাড়াও প্রোটিনগুলি অ্যান্টিবডিগুলি ব্যবহার করে তাদের চিনতে পারে যা ফলস্বরূপ ফ্লুরোসেন্ট লেবেল বহন করে using প্রায়শই একই সাথে অধ্যয়নকৃত প্রোটিনের সাথে প্রায়শই এন্ডোপ্লাজমিক রেটিকুলাম, গোলজি যন্ত্রপাতি, লাইসোসোমস এবং শূন্যস্থানগুলির মতো অর্গানেলগুলির পরিচিত প্রোটিনগুলি দৃশ্যমান হয়, যা অধ্যয়নিত প্রোটিনের স্থানীয়করণের আরও সঠিক নির্ধারণের অনুমতি দেয়।
ইমিউনোহিস্টোকেমিক্যাল পদ্ধতিতে সাধারণত অ্যান্টিবডিগুলি ব্যবহার করা হয় যা এনজাইমগুলিতে সংমিশ্রিত হয় যা লুমিনেসেন্ট বা রঙিন পণ্য গঠনের অনুঘটক করে, যা আপনাকে নমুনায় অধ্যয়নরত প্রোটিনের স্থানীয়করণ এবং পরিমাণের তুলনা করতে দেয়। প্রোটিনের অবস্থান নির্ধারণের জন্য আরও বিরল কৌশল হ'ল সুক্রোজ বা সিজিয়াম ক্লোরাইডের গ্রেডিয়েন্টে কোষ ভগ্নাংশের ভারসাম্য আল্ট্রাসেন্ট্রিফগেশন।
অবশেষে, ধ্রুপদী পদ্ধতিগুলির মধ্যে একটি হ'ল ইমিউনোইলেক্ট্রনিক মাইক্রোস্কোপি, যা ইলেক্ট্রন মাইক্রোস্কোপ ব্যবহৃত হয় তার পার্থক্যের সাথে ইমিউনোফ্লোরেসেন্স মাইক্রোস্কোপির সাথে মূলত অনুরূপ। নমুনাটি বৈদ্যুতিন মাইক্রোস্কোপির জন্য প্রস্তুত করা হয় এবং তারপরে অ্যান্টিবডিগুলির সাথে প্রোটিনের সাথে প্রসেস করা হয় যা বৈদ্যুতিন-ঘন উপাদানগুলির সাথে সংযুক্ত থাকে, সাধারণত সোনার gold
সাইট-নির্দেশিত মিউটেজেনসিস ব্যবহার করে গবেষকরা একটি প্রোটিনের অ্যামিনো অ্যাসিড ক্রম এবং ফলস্বরূপ, এর স্থানিক কাঠামো, কোষের অবস্থান এবং তার ক্রিয়াকলাপের নিয়ন্ত্রণকে পরিবর্তন করতে পারেন। এই পদ্ধতিটি ব্যবহার করে, পরিবর্তিত টিআরএনএ ব্যবহার করে, কেউ প্রোটিনের মধ্যে কৃত্রিম অ্যামিনো অ্যাসিড প্রবর্তন করতে এবং নতুন বৈশিষ্ট্যযুক্ত প্রোটিন তৈরি করতে পারে।
বায়োকেমিক্যাল
একটি বিশ্লেষণ সম্পাদন করা ইন ভিট্রো প্রোটিন অবশ্যই অন্যান্য সেলুলার উপাদান থেকে শুদ্ধ করা আবশ্যক। এই প্রক্রিয়াটি সাধারণত কোষগুলির ধ্বংস এবং তথাকথিত সেল এক্সট্র্যাক্ট প্রাপ্তির সাথে শুরু হয়। তদ্ব্যতীত, সেন্ট্রিফিউগেশন এবং আল্ট্রাসেন্ট্রিফিউগেশন পদ্ধতির সাহায্যে এই নির্যাসকে ভাগ করা যায়: দ্রবণীয় প্রোটিনযুক্ত একটি ভগ্নাংশ, ঝিল্লি লিপিড এবং প্রোটিনযুক্ত একটি ভগ্নাংশ এবং সেলুলার অর্গানেলস এবং নিউক্লিক অ্যাসিডযুক্ত একটি ভগ্নাংশ।

সল্ট আউট দিয়ে প্রোটিন বৃষ্টিপাত প্রোটিনের মিশ্রণ পৃথক করতে ব্যবহৃত হয়, এবং প্রোটিন ঘনত্বকেও মঞ্জুরি দেয়। পলিতকরণ বিশ্লেষণ (কেন্দ্রীভূতকরণ) আপনাকে পৃথক প্রোটিনের অবক্ষেপ ধ্রুবকের মূল্য দ্বারা শেভবার্গস (এস) দ্বারা প্রোটিনের মিশ্রণগুলি ভগ্নাংশ করতে দেয়। বিভিন্ন ধরণের ক্রোমাটোগ্রাফি তখন আণবিক ওজন, চার্জ এবং সত্ত্বার মতো বৈশিষ্ট্যের উপর ভিত্তি করে পছন্দসই প্রোটিন বা প্রোটিনকে পৃথক করতে ব্যবহৃত হয়। এছাড়াও, প্রোটিনগুলি ইলেক্ট্রোফোকাস ব্যবহার করে তাদের চার্জ অনুযায়ী আলাদা করা যায়।
প্রোটিন পরিশোধন প্রক্রিয়াটিকে সহজ করার জন্য, জেনেটিক ইঞ্জিনিয়ারিং প্রায়শই ব্যবহৃত হয়, যা আপনাকে তাদের প্রোটিনগুলির ডেরাইভেটিভগুলি তৈরি করতে দেয় যা তাদের গঠন বা কার্যকলাপকে প্রভাবিত না করে শুদ্ধকরণের জন্য সুবিধাজনক convenient "লেবেলগুলি", যা ছোট অ্যামিনো অ্যাসিডের ক্রম, উদাহরণস্বরূপ, 6 বা ততোধিক হিস্টিডাইন অবশিষ্টাংশের একটি চেইন, এবং প্রোটিনের একটি প্রান্তের সাথে সংযুক্ত থাকে। যখন "লেবেলযুক্ত" প্রোটিন সংশ্লেষকারী কোষগুলির নিষ্কাশন নিকেল আয়নগুলি সহ ক্রোমাটোগ্রাফিক কলামের মধ্য দিয়ে যায়, তখন হিস্টিডিন নিকেলের সাথে আবদ্ধ হয় এবং কলামে থাকে, যখন লাইসেটের অবশিষ্ট উপাদানগুলি কলামের অনাহারী (নিকেল-চ্লেট ক্রোমাটোগ্রাফি) দিয়ে যায়। গবেষকরা জটিল মিশ্রণ থেকে নির্দিষ্ট প্রোটিনগুলি বিচ্ছিন্ন করতে বেশিরভাগ ক্ষেত্রে অ্যাফিনিটি ক্রোমাটোগ্রাফি ব্যবহার করে সহায়তা করার জন্য আরও অনেকগুলি লেবেল ডিজাইন করা হয়েছে।
প্রোটিন বিশুদ্ধকরণের ডিগ্রি নির্ধারণ করা যেতে পারে যদি এর আণবিক ওজন এবং আইসোইলেকট্রিক পয়েন্টটি পরিচিত হয় - বিভিন্ন প্রকার জেল বৈদ্যুতিন সংক্ষিপ্তসারগুলি ব্যবহার করে - বা প্রোটিন কোনও এনজাইম হলে এনজাইমেটিক ক্রিয়াকলাপ পরিমাপ করে by ভর স্পেকট্রোম্যাট্রি আপনাকে নির্বাচিত প্রোটিনকে তার আণবিক ওজন এবং তার টুকরাগুলির ভর দ্বারা সনাক্ত করতে দেয়।
প্রোটেওমিক্স
কোষ প্রোটিনের সামগ্রিকতার জন্য একটি প্রোটোম বলা হয়, এর অধ্যয়ন - প্রোটোমিক্স, জিনোমিক্সের সাথে সাদৃশ্য দ্বারা ডাকা হয়। মূল পরীক্ষামূলক প্রোটোমিক্স পদ্ধতিগুলির মধ্যে রয়েছে:
- 2 ডি ইলেক্ট্রোফোর্সিস, যা বহুগুণ উপাদান প্রোটিন মিশ্রণ পৃথক করার অনুমতি দেয়,
- ভর স্পেকট্রোম্যাট্রি যা উচ্চ উপাদানগুলির মাধ্যমে তাদের উপাদানগুলির পেপটাইডগুলির দ্বারা প্রোটিন সনাক্তকরণের অনুমতি দেয়,
- প্রোটিন মাইক্রোয়ারে, যা আপনাকে একই সাথে কোষে প্রচুর সংখ্যক প্রোটিনের সামগ্রী পরিমাপ করতে দেয়,
- দ্বি সংকর খামির ব্যবস্থা , যা আপনাকে পদ্ধতিগতভাবে প্রোটিন-প্রোটিন মিথস্ক্রিয়াগুলি অধ্যয়ন করতে দেয়।
একটি কোষে প্রোটিনের সমস্ত জৈবিকভাবে গুরুত্বপূর্ণ ইন্টারঅ্যাকশনগুলির সামগ্রিকতাটিকে একটি ইন্টারেক্টোম বলে। সমস্ত সম্ভাব্য ধরণের তৃতীয় কাঠামোর প্রতিনিধিত্বকারী প্রোটিনগুলির কাঠামোর একটি নিয়মতান্ত্রিক অধ্যয়নকে বলা হয় কাঠামোগত জিনোমিক্স।
কাঠামোর ভবিষ্যদ্বাণী এবং মডেলিং
কম্পিউটার প্রোগ্রামগুলি ব্যবহার করে স্থানিক কাঠামোর পূর্বাভাস (সিলিকো মধ্যে) প্রোটিন মডেলগুলি তৈরির অনুমতি দেয় যার কাঠামোগত পরীক্ষামূলকভাবে এখনও নির্ধারিত হয়নি। হোমোলজিকাল মডেলিং হিসাবে পরিচিত সর্বাধিক সফল ধরণের কাঠামোগত ভবিষ্যদ্বাণী, সিমুলেটেড প্রোটিনের মতো অ্যামিনো অ্যাসিড ক্রমের অনুরূপ বিদ্যমান "টেম্পলেট" কাঠামোর উপর নির্ভর করে। প্রোটিনের স্থানিক কাঠামোর পূর্বাভাস দেওয়ার পদ্ধতিগুলি প্রোটিনের জেনেটিক ইঞ্জিনিয়ারিংয়ের বিকাশের ক্ষেত্রে ব্যবহার করা হয়, যার সাহায্যে ইতিমধ্যে প্রোটিনের নতুন তৃতীয় কাঠামো প্রাপ্ত করা হয়েছে। আরও জটিল গণনামূলক কাজ হ'ল আন্তঃআণু সংক্রান্ত মিথস্ক্রিয়া যেমন আণবিক ডকিং এবং প্রোটিন-প্রোটিন মিথস্ক্রিয়াগুলির পূর্বাভাস।
প্রোটিনগুলির ভাঁজ এবং আন্তঃআণু সংক্রান্ত মিথস্ক্রিয়াগুলি আণবিক যান্ত্রিকগুলি ব্যবহার করে মডেল করা যেতে পারে। , বিশেষত, আণবিক গতিশক্তি এবং মন্টে কার্লো পদ্ধতি, যা ক্রমবর্ধমান সমান্তরাল এবং বিতরণ করা কম্পিউটিংয়ের সুবিধা গ্রহণ করছে (উদাহরণস্বরূপ, ভাঁজ @ হোম প্রকল্প)।ছোট α- হেলিকাল প্রোটিন ডোমেনগুলি ভাঁজ করা, যেমন ভিলিন প্রোটিন বা এইচআইভি প্রোটিনগুলির মধ্যে একটি, সফলভাবে মডেল করা হয়েছে সিলিকো মধ্যে। কোয়ান্টাম মেকানিক্সের সাথে স্ট্যান্ডার্ড আণবিক গতিবিদ্যা মিশ্রিতকারী হাইব্রিড পদ্ধতিগুলি ব্যবহার করে ভিজ্যুয়াল রঙ্গক রোডোপসিনের বৈদ্যুতিন রাজ্যগুলি তদন্ত করা হয়েছে।